
范祖森课题组揭示环状RNA circBtnl1负向调控肠道干细胞自我更新的新机制
2023年1月30日,中国科学院生物物理研究所范祖森课题组在《The EMBO JOURNAL》杂志在线发表了题为"Noncoding RNA circBtnl1 suppresses self-renewal of intestinal stem cells via disruption of Atf4 mRNA stability"的文章,该研究揭示了在肠道干细胞高表达的环状RNA circBtnl1在稳态情况下抑制肠道干细胞的自我更新,并通过调控Atf4/Sox9信号调节干性维持的分子机制。
肠道是体内最大的消化吸收器官和外周免疫器官,主要包括肠上皮和固有层两部分。肠上皮的所有成熟细胞均由位于隐窝底部的肠道干细胞产生,这些干细胞具有自我更新和分化能力。肠道干细胞作为肠道上皮的种子细胞,对于整个肠道上皮的更新和稳态维持至关重要。范祖森课题组最近鉴定发现肠道上皮细胞新亚群Tuft2细胞具有抵抗病原体感染的作用,参与肠道黏膜稳态的维持(Immunity, 2022)。前期发现了长链非编码RNA lncGata6 调控肠道干细胞的自我更新(Nature Cell Biology, 2018)。发现肠道驻留ILC2 细胞分泌IL-13介导肠道干细胞高表达circPan3促进其再生能力(Nature Immunity, 2019)。还发现肠道神经细胞分泌的5-HT激活PGD2+巨噬细胞,使其产生PGE2继而激活Wnt信号通路促进肠道干细胞的干性(Cell Research, 2022)。并发现肠道神经细胞分泌的5-HT还能够激活肠癌干细胞的干性和肠癌发生,阻断5-HT信号显著抑制肠癌的发生和转移(Neuron, 2022)。
在该研究中,我们发现circBtnl1敲低能够促进肠道干细胞的增殖和类器官的生长。我们构建了circBtnl1敲除小鼠,发现circBtnl1缺失后小鼠肠道隐窝和肠绒毛明显增多,肠道干细胞的数目也显著增多。同时,circBtnl1敲除后并不影响其母基因Btnl1的mRNA和蛋白水平的表达,表明circBtnl1通过一种不依赖于Btnl1 mRNA和蛋白的方式调节肠道干细胞的自我更新能力。在稳态情况下,circBtnl1和RNA解旋酶Ddx3y竞争性结合转录因子Atf4的mRNA,进而抑制Atf4 mRNA的稳定性,继而抑制干性因子Sox9的转录表达,抑制肠道干细胞的再生能力,首次揭示circBtnl1对肠道稳态的负性调节作用。总之,该研究揭示了非编码RNA circBtnl1负向调控肠道干细胞自我更新的新机制,发现了Atf4/Sox9信号参与干性稳态维持的新功能,为解析肠道干细胞的稳态调控机制提供了新视角。
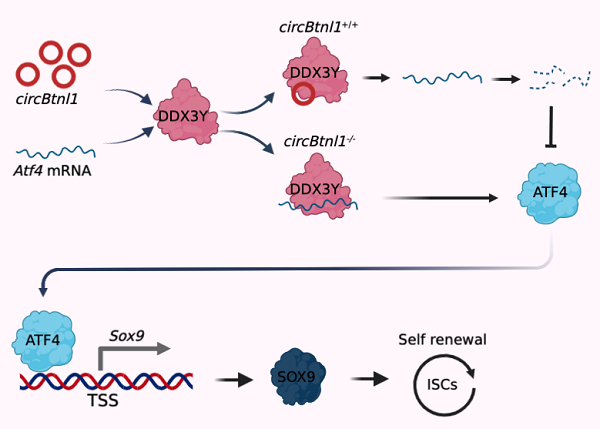
图. circBtnl1负向调控肠道干细胞自我更新的分子机制
中国科学院生物物理研究所范祖森研究员、田勇研究员和郑州大学朱平平研究员为本文的共同通讯作者,助理研究员郭晖和博士研究生张嘉航为并列第一作者。该研究得到了科技部重点研发计划、国家自然科学基金和中科院先导专项等经费支持。
文章链接:http://doi.org/10.15252/embj.2022112039
(供稿:范祖森研究组)
附件下载: