
生物物理研究所在细胞原位研究领域取得新进展
细胞内部的纳米机器与超微结构是参与生命活动的基本单元,它们通过彼此之间的紧密协作执行特定的生理功能。所谓眼见为实,在细胞原位研究这些复杂精密的纳米结构的组装与功能一直是生命科学的前沿热点。冷冻电子断层扫描成像(cryo-ET)是目前主要的原位结构解析技术,但受电子束穿透能力限制,需要利用聚焦离子束将细胞和组织样品减薄成200纳米左右的薄片后成像,而这种随机减薄的技术,对细胞内丰度相对较低的目标的研究带来了极大的挑战,制备的样品往往无法保留感兴趣的目标。
为了解决上述样品减薄制备的技术瓶颈,来自中国科学院生物物理研究所的团队分别发展了两种冷冻细胞精准减薄技术路线, 1月16日,以背靠背的形式在《Nature Methods》杂志在线发表了题为"ELI trifocal microscope: a precise system to prepare target cryo-lamellae for in situ cryo-ET study"和"Integrated multimodality microscope for accurate and efficient target-guided cryo-lamellae preparation"的研究论文,提出了利用荧光成像引导聚焦离子束(focused ion beam, FIB)减薄的方案,并分别研发了集成式光电融合冷冻生物样品减薄系统(图1)。
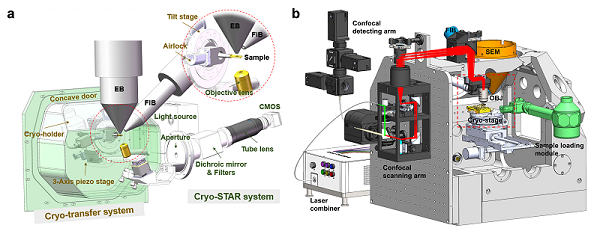
图1. ELI-TriScope(a)和CLIEM(b)系统设计图
其中ELI-TriScope系统在双束扫描电子显微镜内部整合了一个基于冷冻样品杆的传输系统(cryo-transfer system),以及一个内嵌的光学成像系统(cryogenic SimulTAneous monitoR system, cryo-STAR)。该系统在扫描电镜的内部将电子束,光束和离子束同时聚焦在样品台上同一位置,实现了聚焦离子束减薄样品的同时进行荧光实时监控成像。该系统通过监测目标分子的实时荧光信号,能够精确且高效地制备包含目标结构的冷冻含水切片。
CLIEM系统则将激光共聚焦显微镜集成到双束电镜中,通过高质量的全细胞多色三维荧光成像,可精准定位研究目标的三维空间位置,并通过巧妙的投影变换,将光镜图像与聚焦离子束图像进行快速精准关联,实现了几十纳米精度的聚焦离子束定点减薄。此外,团队还开发了"虚拟切片"功能,可生成细胞不同位置虚拟切片的荧光图像,能够在拥挤的细胞中确定最优的切割位点。
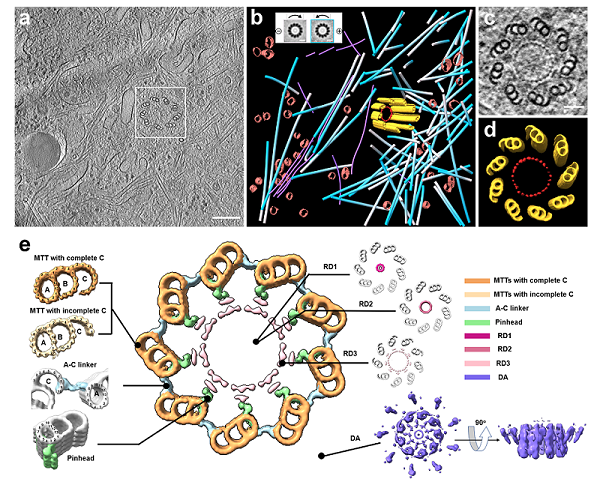
图2.(a)精准靶向中心体的冷冻含水切片透射电镜图;(b-e) 人体中心粒的原位结构。中央大图展示冷冻电子断层扫描成像技术解析获得的人中心粒横截面图。MTTs,微管三联体;RD1-3,中心粒内部环状密度;DA,远端附属结构。A-C linker,A管C管连接区。Pinhead,针头状结构。
研究团队利用上述系统高效制备了细胞的冷冻含水切片样品,并通过随后的冷冻电子断层扫描成像数据分析,发现了人体中心体新的原位结构特征,并开展了细胞器互作位点等细胞超微结构的研究(图2)。这些研究结果证明,ELI-TriScope和CLIEM作为先进的、精准的、高效的冷冻聚焦离子束减薄技术,为定点制备冷冻电子断层扫描成像生物切片样品提供了新的解决方案,在研究细胞内特定事件的超微结构方面具有广泛应用潜力,有望推动未来原位结构生物学的发展。
中科院生物物理所孙飞研究员、季刚正高级工程师和朱赟研究员为ELI-TriScope工作的共同通讯作者,蛋白质科学研究平台生物成像中心高级工程师李硕果、孙飞课题组博士生王子岩为该项工作的共同第一作者。
中科院生物物理所徐涛院士、纪伟研究员和北京大学郭强研究员为CLIEM工作的共同通讯作者,中科院生物物理所李尉兴高级工程师、卢婧高级工程师、肖珂工程师和广州实验室的周茂阁副研究员为共同第一作者。
上述研究获得国家重点研发计划、国家自然科学基金、中国科学院战略性先导科技专项(B类)、中国科学院任务/知识创新工程重要方向项目的资助。样品制备、数据收集和分析等工作受到生物物理所蛋白质科学研究平台生物成像中心相关工作人员的大力支持和帮助。
文章链接:
ELI TriScope:https://www.nature.com/articles/s41592-022-01748-0
CLIEM:https://www.nature.com/articles/s41592-022-01749-z
相关新闻稿链接:
http://www.ibp.cas.cn/kyjz/zxdt/202301/t20230113_6599317.html
http://www.ibp.cas.cn/kyjz/zxdt/202301/t20230113_6599093.html
(供稿:孙飞研究组)
附件下载: