
王立堃团队发现肿瘤细胞未折叠蛋白响应调控肿瘤免疫的新机制
错误折叠蛋白在内质网腔中累积会造成内质网应激(ER stress,ERS),从而激活未折叠蛋白响应(unfolded protein responses,UPR)。UPR包含三条信号通路:IRE1(inositol-requiring enzyme 1),PERK(PKR-like ER-resident kinase)与ATF6α(activating transcription factor 6α)。近年来的研究发现,UPR与包括癌症、糖尿病、神经退行性疾病等在内的多种疾病的发生发展密切相关。肿瘤组织中的细胞面临缺氧、营养匮乏、酸性等恶劣环境,肿瘤细胞内代谢变化、基因组完整性受损和过氧化物堆积,这些因素都可能造成内质网应激并引起UPR。研究表明肿瘤细胞通过利用UPR缓减内质网压力,帮助细胞存活。另一方面,UPR对于免疫细胞的调节也见诸报道。目前,对UPR与癌症间的联系的研究主要聚焦在UPR信号对肿瘤微环境中肿瘤细胞或者免疫细胞自身功能的调节上。然而,肿瘤微环境极其复杂,由多种细胞及细胞间基质组成,肿瘤细胞内UPR信号是否通过调节自身的分泌因子影响周围免疫细胞功能仍然不清楚。
2022年11月8日,中国科学院生物物理研究所的王立堃团队在《Cell Metabolism》杂志上在线发表了题为" Cancer cell-intrinsic XBP1 drives immunosuppressive reprogramming of intratumoral myeloid cells by promoting cholesterol production"的研究论文。该研究发现,肿瘤细胞内IRE1α/XBP1信号通路的活化通过促进自身胆固醇的合成和分泌,抑制抗肿瘤免疫,促进了肿瘤生长。
该课题组利用黑色素瘤和结肠癌小鼠模型发现,敲除肿瘤细胞IRE1α或者XBP1能有效抑制肿瘤在野生型小鼠上的生长,但不影响肿瘤在免疫缺陷小鼠中的生长。这说明肿瘤细胞中的IRE1α/XBP1信号通过调节肿瘤免疫促进了肿瘤的生长。研究者进一步利用质谱流式技术分析发现,肿瘤细胞内XBP1的缺失减少了肿瘤微环境中髓系来源的免疫抑制性细胞(myeloid-derived suppressor cell, MDSC),增加了活化的CD8 T细胞。
为了深入理解肿瘤细胞中XBP1对肿瘤免疫的调节作用,研究者通过转录组测序和脂质组学分析发现,肿瘤细胞内XBP1的缺失减少了肿瘤组织中胆固醇的水平。继而利用ChIP-PCR技术,研究人员发现XBP1是胆固醇合成途径中关键酶HMGCR的转录调控因子。体外实验也发现,胆固醇可以刺激MDSC的活化和扩增。同时,抑制肿瘤细胞内胆固醇的合成能显著减少肿瘤内MDSC水平、增加CD8 T细胞的数量,从而限制肿瘤的生长。这些结果表明,肿瘤细胞内的XBP1通过促进胆固醇的合成负调控抗肿瘤免疫。
接下来,课题组对肿瘤细胞的胆固醇如何传递至MDSC以及MDSC如何接收胆固醇的机制作了深入研究。由于小细胞外囊泡(small extracellular vesicle, sEV)是细胞间信号传递的常用介质,研究者探索了XBP1是否调节sEV的分泌或者sEV上胆固醇的变化。他们发现,敲低中肿瘤细胞XBP1减少了sEV的分泌以及sEV上胆固醇的水平。并且,XBP1缺失的肿瘤细胞来源的sEV刺激MDSC扩增和活化的能力也被大大地削弱。此外,在用sEV刺激的同时,抑制MDSC巨胞饮作用也明显地限制了MDSC的扩增和活化。这些研究表明,肿瘤细胞内的胆固醇通过sEV传递给MDSC,MDSC通过巨胞饮作用摄取胆固醇。
最后,课题组发现IRE1α/XBP1信号通路的抑制剂KIRA8能很明显地抑制肿瘤的生长,与PD-1抗体联合具有更佳地治疗肿瘤的效果。
综上所述,这项研究揭示了肿瘤细胞内IRE1α/XBP1信号通路调节肿瘤免疫的机制,发现UPR调控胆固醇合成、参与跨细胞信号传递的新功能,为开发新的抗肿瘤药物提供了新的视野。
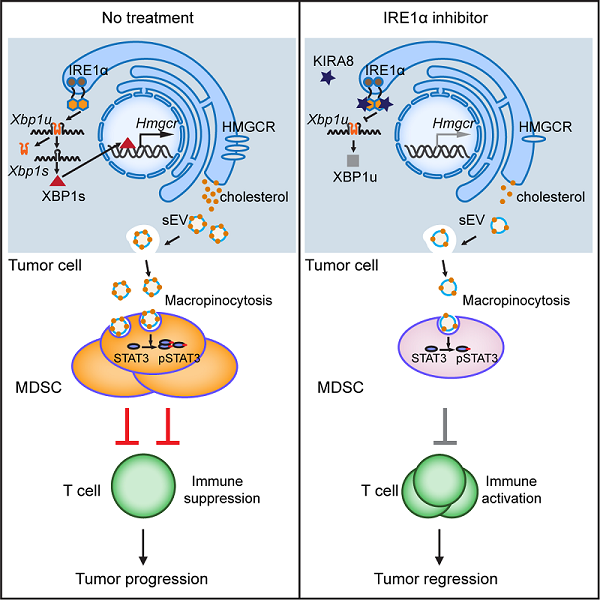
模式图(引自原文)
左边,肿瘤细胞的UPR信号分子XBP1上调HMGCR表达和胆固醇合成,后者通过sEV形式分泌并被MDSC摄取,促进MDSC的扩增和活化,抑制抗肿瘤免疫。右边,IRE1α的激酶抑制剂KIRA8能有效恢复CD8 T细胞活性,限制肿瘤生长。
杨再立博士(毕业于王立堃组,现为清华大学博士后)为该研究论文的第一作者,生物物理研究所王立堃研究员为该论文的通讯作者。
文章链接:https://www.sciencedirect.com/science/article/pii/S1550413122004612?via%3Dihub
(供稿:王立堃研究组)
附件下载: