
李新建团队揭示衣康酸通过诱导溶酶体的生物合成增强机体的抗菌先天免疫能力
先天免疫是宿主细胞抵抗病毒、细菌等病原体入侵的防御机制,在此防御过程中溶酶体依赖于其内部的水解酶分解入侵的病原体,因此增加细胞内溶酶体的数量能够提高宿主的先天免疫防御能力。已有的研究报道TFEB是调控溶酶体生物合成的关键转录因子,在非应激状态下TFEB依赖于蛋白激酶mTOR介导的磷酸化与锚定蛋白14-3-3结合,表现出胞质定位;在应激状态下,例如,营养物质剥夺、氧化应激以及病原体入侵等条件下,TFEB脱离14-3-3的锚定,随之从胞质转移至细胞核内。在细胞核内TFEB激活参与溶酶体生物合成的基因表达,进而诱导溶酶体的生物合成。
衣康酸(itaconate)是一种具有抗炎功能的三羧酸循环代谢产物,在线粒体基质中借助代谢酶IRG1的催化活性由顺乌头酸(cis-aconitate)转化而来。从分子结构角度看,衣康酸是一种含有烯基的不饱和羧酸,具有很强的亲电子活性,能够通过thia-Michael加成反应将蛋白质半胱氨酸残基烷基化。2022年6月3日,中国科学院生物物理研究所李新建研究团队在《Molecular Cell》杂志上在线发表了题为 Itaconate is a lysosomal inducer that promotes antibacterial innate immunity (DOI: https://doi.org/10.1016/j.molcel.2022.05.009) 的研究论文。该研究揭示了巨噬细胞在抵御细菌入侵过程中通过激活代谢酶IRG1的表达产生衣康酸,随后的质谱鉴定结果发现衣康酸烷基化(alkylation)修饰TFEB Cys212位点,鉴于Cys212邻近 Ser211,Cys212烷基化修饰阻止了蛋白激酶mTOR介导的Ser211磷酸化并破坏已被磷酸修饰的TFEB与14-3-3结合,导致TFEB从胞质转移至细胞核,进而激活溶酶体的生物合成,提高巨噬细胞抵御细菌入侵的能力。为了进一步证实衣康酸介导的TFEB烷基化修饰能够提高机体的抗菌先天免疫能力,研究人员运用基因编辑技术将小鼠TFEB烷基化修饰位点由半胱氨酸突变成丝氨酸,结果显示在伤寒沙门氏菌感染模型中,TFEB烷基化修饰缺陷型小鼠比野生型小鼠的存活时间明显缩短、体内器官荷菌数量明显增多;进一步的实验结果表明:给野生型小鼠注射具有膜通透性的衣康酸衍生物4-辛酯衣康酸(OI)可显著延长伤寒沙门氏菌感染小鼠的生存时间,提示衣康酸介导的TFEB烷基化修饰是维持机体抗细菌感染能力的重要途径。综上所述,该研究成果揭示了在被细菌感染的条件下,衣康酸能够诱导巨噬细胞溶酶体的生物合成,进而增强机体抗菌先天免疫的能力。因此,该研究拓展了衣康酸抗炎以外的生物学功能。
中国科学院生物物理研究所博士后张振兴、陈超为该论文的共同第一作者,李新建研究员为该论文的唯一通讯作者。该研究得到了国家自然科学基金委、中国科学院和国家重点研发计划的经费支持。
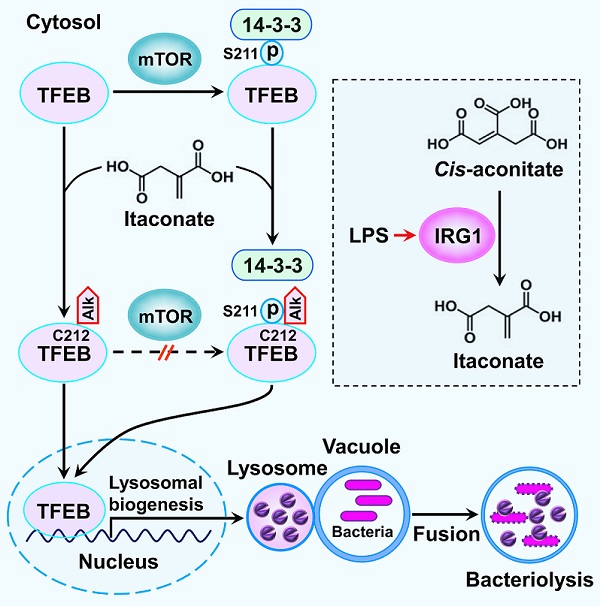
图. 在细菌感染的条件下,脂多糖(LPS)激活的巨噬细胞表达衣康酸合成酶IRG1,在线粒体中IRG1将顺乌头酸(cis-aconitate)转化为衣康酸(itaconate)。随后衣康酸在胞质中对转录因子TFEB进行烷基化修饰,该修饰能够阻止蛋白激酶mTOR对TFEB进行磷酸化修饰并破坏已被mTOR磷酸化修饰的TFEB与14-3-3结合,导致TFEB从胞质转移至细胞核。在细胞核内TFEB激活溶酶体的生物合成,提高巨噬细胞清除入侵细菌的先天免疫能力。
文章链接:https://www.cell.com/molecular-cell/fulltext/S1097-2765(22)00443-9
(供稿:曾益新/李新建研究组)
附件下载: