
梁伟团队揭示一种依赖于质膜纳米孔形成的细胞死亡形式:Poroptosis
2022年5月30日,中国科学院生物物理研究所梁伟课题组在《iScience》杂志在线发表了题为" Poroptosis: A form of cell death depending on plasma membrane nanopores formation"的文章。该研究揭示:ppM1肽能够在肿瘤细胞膜上形成不可修复的跨膜孔,导致肿瘤细胞的免疫原性死亡,这被定义为poroptosis。poroptosis直接依赖于细胞膜纳米孔,而与细胞死亡的上游信号无关。ppM1诱导的poroptosis以细胞内LDH的持续释放为特征。这一独特特征不同于其他由冷冻-解冻(F/T)和洗涤剂引起的急性坏死类型,后者导致细胞内LDH的突然释放。实验结果表明,稳定的跨膜纳米孔介导的亚急性细胞死亡在随后的激活免疫中起着至关重要的作用,从而转化为抗肿瘤免疫微环境。选择性地在肿瘤细胞中产生poroptosis可能是一种有前景的癌症治疗策略。
免疫原性死亡是指细胞死亡后能够激活宿主针对其所含抗原的特异性免疫反应。诱导肿瘤细胞免疫原性死亡作为肿瘤免疫治疗的重要手段,不仅能够直接杀伤肿瘤细胞,同时能够激活特异性抗肿瘤免疫反应,进一步清除残留病灶或转移病灶,预防肿瘤复发。研究表明细胞死亡时膜孔的形成与免疫原性死亡之间存在某种联系,由此我们提出科学假说,直接在肿瘤细胞膜上形成膜孔诱导的细胞坏死,能够引起肿瘤免疫原性死亡。多肽类化合物具备较强的成药潜力,采用多肽在肿瘤细胞膜上形成膜孔可行性较高。
研究表明p53蛋白的MDM2结合域的氨基酸片段具备肿瘤细胞膜渗透的能力,因此我们采用衍生于p53蛋白或MDM2蛋白的肽段,结合膜孔形成肽的结构特点,设计、筛选、优化后得到了具备广谱抗肿瘤效果的多肽ppM1。ppM1具备广谱的抗肿瘤效果,且不依赖于p53通路而是靶向于细胞膜。随后,我们分别在体外和体内证明了ppM1能够诱导肿瘤免疫原性死亡。ppM1形成的膜孔能够诱导肿瘤细胞坏死,引发多种DAMPs释放和炎症因子表达升高。ppM1处理后的坏死肿瘤细胞能够显著激活BMDCs 成熟,并且小鼠皮下注射能够诱导抗肿瘤免疫保护。体内肿瘤治疗结果表明,瘤内注射ppM1多肽后,能够提高瘤内免疫细胞的浸润比例,改变肿瘤免疫微环境。最后我们在不同的肿瘤模型上,评价了ppM1的治疗效果。在"hot-tumor"模型(MC38模型),瘤内注射ppM1多肽后,能够达到接近100%的治愈率,并且这种治疗效果依赖于完整的免疫系统,尤其是CD8+ T细胞和CD4+ T细胞;而"cold-tumor"模型(4T1-MUC1模型),对免疫治疗(PD-1抗体或MUC-1疫苗)几乎不响应,联合ppM1多肽治疗后,能够显著改善免疫治疗(PD-1抗体或MUC-1疫苗)的疗效。此外,我们比较了膜孔介导的坏死与膜裂解介导的坏死的区别以及其对免疫原性死亡的影响,并提出了亚急性死亡和急性死亡的概念。膜孔介导的肿瘤细胞亚急性死亡能够诱导BMDCs成熟,而膜裂解介导的肿瘤细胞急性死亡则不能,这表明亚急性死亡对于诱导肿瘤细胞免疫原性死亡至关重要。
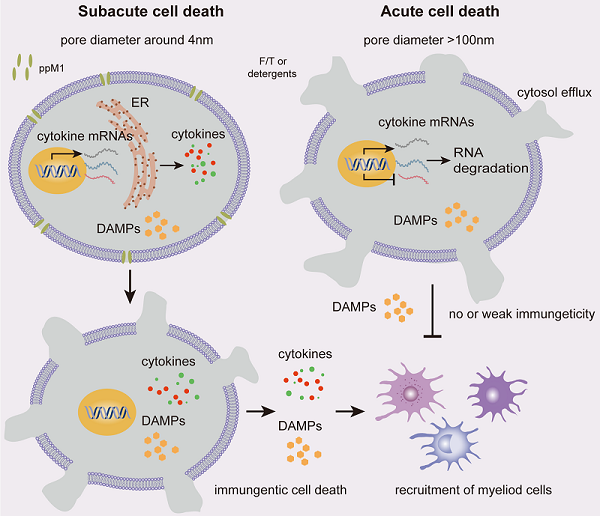
图. ppM1引发poroptosis的机制示意图。(由ppM1作用形成的纳米孔稳定且不可逆,可诱导肿瘤细胞亚急性死亡。处于亚急性死亡中的细胞可以在一段时间内维持相对完整的亚细胞器,从而可以继续细胞因子的基因转录或蛋白质翻译,从而触发免疫原性死亡,而冻融或洗涤剂诱导的急性细胞死亡则不能。)
中国科学院生物物理研究所的梁伟研究员和国家纳米科学中心的王琛研究员是本研究论文的通讯作者。中国科学院生物物理研究所博士毕业生李浩和助理研究员王子昊为本文的共同第一作者。本研究工作获得国家自然科学基金的资助。
文章链接:https://doi.org/10.1016/j.isci.2022.104481
(供稿:梁伟研究组)
附件下载: