
赵岩课题组与合作者揭示人源钙通道CaV3.3门控机制以及与药物识别机制
钙离子(Ca2+)是细胞内重要的第二信使,参与神经信号传递、肌肉收缩、调控细胞的增殖、凋亡和分化等多种重要生理过程。电压门控钙离子通道(CaV)可以响应细胞膜电位变化而激活,介导Ca2+进入细胞,进而激活一系列下游信号通路。在人类基因组中,编码电压门控钙离子通道的基因有10种。根据膜电位去极化激活阈值分为两类:高电压激活(HVA)和低电压激活(LVA)钙通道,高电压激活的钙通道需要较强的去极化刺激才能激活。低电压激活的钙通道也称为T型钙离子通道可以在较弱的去极化刺激下激活,其特点为低电压激活,快速失活。这种门控特性使其在细胞膜发生轻微去极化的情况下就会导致通道的打开,是细胞在接近静息电位状态时胞内Ca2+的重要来源。T型钙离子通道广泛分布于各种组织,参与心脏起搏、肌肉兴奋-收缩偶联以及细胞生长的调控等过程,其功能异常与心律失常、高血压、癫痫和精神病等相关。因此,T型钙离子通道是重要的药物研究靶标,对其结构和功能特征的全面了解以及揭示药物分子与离子通道的作用机制具有重大意义。
2022年04月19日,中国科学院生物物理研究所赵岩课题组和北京大学药学院黄卓课题组合作,在《Nature communications》期刊上合作发表题为“Structure, gating, and pharmacology of human CaV3.3 channel”的文章,该研究利用单颗粒冷冻电镜技术解析了人源电压门控T型钙离子通道CaV3.3在未结合底物状态(Apo)(图1a)以及分别与抗高血压药米贝拉地尔(Mibefradil)、解痉挛和抗胆碱能药物奥替溴铵(Otilonium Bromide)和抗精神病药匹莫齐特(Pimozide)三个小分子药物结合状态下的高分辨率结构,阐明了不同药物分子如何高效阻断CaV3.3通道。结合电生理实验,首次鉴定了调控T型钙离子通道在低电压下激活的结构元件。
研究人员发现在T型钙离子通道CaV3.3中包含一个长螺旋(S6III),包括跨膜部分(S6TM)和胞质部分(S6Cyto)。其中,S6TM参与构成通道在细胞质一侧的门闸。位于胞质中的S6Cyto部分富含带正电的氨基酸残基(19个氨基酸残基中有12个为精氨酸或赖氨酸),该序列特征在所有低电压激活的T型CaV通道中保守,但在高电压激活的CaV通道(例如CaV2.2)中不保守。为了验证S6Cyto的功能,我们将S6Cyto螺旋中的12个正电氨基酸突变为电中性的谷氨酰胺(CaV3.312Q)。电生理实验结果表明,CaV3.312Q激活过程的电压依赖性向膜电位去极化方向移动(图1b),暗示了S6Cyto中的正电荷可能感受膜电位的变化,使通道在接近静息膜电位附近开放。为了进一步验证该推测,我们在S6TM和S6Cyto部分的交界处引入甘氨酸突变(CaV3.33G),将完整的S6III螺旋结构破坏为两段螺旋。电生理实验结果表明,CaV3.33G倾向于在更加去极化的膜电位条件下被激活,进一步说明了带正电荷的 S6Cyto 区能够响应膜电位的变化,并通过螺旋刚性结构直接传递给S6TM区,从而影响门控通道的开放。
该研究还解析了CaV3.3分别与三个药物小分子结合状态下的高分辨率结构(图1c)。尽管这些药物小分子均结合在中央空腔,但是不同小分子与其结合位点周围残基的关键相互作用并不相同。同时,我们在结构中发现了多个磷脂分子的密度,磷脂分子不同程度地深入到中央空腔中并参与药物小分子与CaV3.3的结合,对稳定这些药物分子也起到重要作用。这些结构清楚地阐明了这些药物分子如何高效阻断T型CaV通道,为未来药物的设计和开发提供了结构基础。
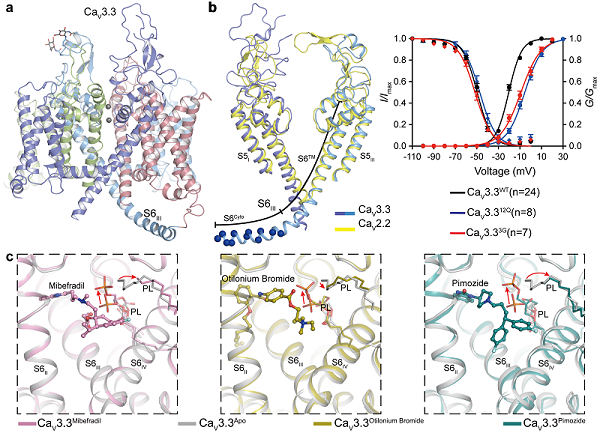
图1:T型钙离子通道CaV3.3低电压激活的关键元件以及与三个小分子药物识别的结构信息
中国科学院生物物理所赵岩研究员是本研究论文的通讯作者。生物物理所副研究员何玲莉和硕士研究生于卓亚、北京大学硕士研究生耿泽和研究员黄卓为本文的共同第一作者。中国科学院生物物理研究所生物成像平台为本研究提供了设备和技术支持。本研究获得了科技部重点研发计划、中国科学院战略性先导科技专项(B类)、国家自然科学基金委员会项目和中国科学院青促会的资助。
文章链接:https://www.nature.com/articles/s41467-022-29728-0
(供稿:赵岩研究组)
附件下载: