
李梅课题组与合作者揭示紫细菌光合RC-LH1超分子复合物二聚体的精细结构
2022年4月13日,《Nature Communications》杂志在线刊登了中国科学院生物物理研究所李梅课题组与英国利物浦大学刘鲁宁课题组、日本RIKEN生物系统动力学研究中心Shirouzu课题组共同合作完成的研究论文,题为"Structural basis for the assembly and quinone transport mechanisms of the dimeric photosynthetic RC-LH1 supercomplex"。
光合作用将太阳能转化为化学能,为世间万物提供赖以生存的能量和食物,被誉为"地球上最重要的化学反应"。厌氧变形菌光合紫细菌是地球上最早出现的生命之一,也是研究细菌光合作用的理想模式生物。紫细菌光化学反应首先发生在光化学反应中心(Reaction center,RC)和捕光复合物1(Light-harvesting 1,LH1)形成的超分子光合元件RC-LH1上。RC-LH1由多个αβ-异二聚体组成的LH1天线环绕在RC周围,LH1将激发能量传递给RC,进一步发生光诱导的电荷分离反应,并将电子通过RC-LH1结合的醌分子向下游传递。
紫细菌RC的晶体结构早在1985年即被解析,完成该项工作的三位科学家因此获得1988年诺贝尔化学奖;然而,对RC-LH1的结构研究相对落后,且其组成和结构在不同的光合细菌物种中表现出多样性。在大多数红杆菌属(Rhodobacter)中RC-LH1以二聚体形式存在,代表了非放氧光合细菌中最大的超分子机器,但由于缺乏高分辨率结构信息,其组装过程及其光能和电子传递的分子机制尚不清晰。
该研究报道了光合紫细菌Rhodobacter sphaeroides的RC-LH1超复合物的七种不同状态的冷冻电镜结构,包括RC-LH1单体结构(分辨率为2.79Å)、RC-LH1的两种不同状态的双体结构(分辨率为2.74Å和2.90Å)、敲除突变ΔpufX和ΔpufY的单体结构(分辨率为4.20Å和2.86Å)、以及ΔpufY的两种不同状态的双体结构(分辨率为3.08Å和3.45Å)(图1)。除之前熟知的3个RC亚基、LH1的α和β亚基、PufX亚基之外,在上述结构中还鉴定出一个全新亚基,命名为PufY。该项工作中,研究人员首次全面系统地揭示了光合蛋白复合物RC-LH1的二聚体结构,通过对这些三维结构的深入分析,并结合遗传敲除实验和计算机模拟分析技术,阐明了PufX和PufY亚基在维持RC-LH1复合物双体结构和功能完整性中所发挥的重要作用,鉴定出该复合物中醌分子的交换途径,提出了二聚体RC-LH1复合物的分步组装过程。
该研究揭示了细菌光合复合物在结构层面上的多变性和模块化组装的精细过程,以及二聚体RC-LH1发挥光合作用功能的分子机理,这些特性确保了高效的捕光、激发能量转移和电子传递,从而使得光合细菌在外界不断变化的环境条件下高效地进行光合作用。
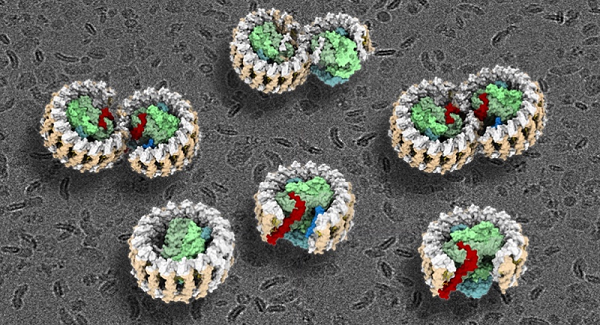
图1.球形红细菌野生型和突变型RC-LH1光合复合物的冷冻电镜结构
在该项工作中,英国利物浦大学刘鲁宁教授、中国科学院生物物理研究所李梅研究员、日本RIKEN生物系统动力学研究中心Shirouzu研究员为共同通讯作者,生物物理所曹鹏博士、利物浦大学博士研究生Laura Bracun和日本RIKEN生物系统动力学研究中心Atsushi Yamagata博士为该项工作的共同第一作者。该研究工作得到了科技部重点研发计划、国家自然科学基金、中国科学院B类先导专项和中国科学院前沿科学重点研究项目的共同资助。数据收集和样品分析等工作得到了生物物理所生物成像中心、生物物理所蛋白质科学研究平台等有关工作人员的大力支持和帮助。
文章链接:https://www.nature.com/articles/s41467-022-29563-3
(供稿:李梅研究组)
附件下载: