
蔡华清课题组揭示巨胞饮体成熟过程的分子机制
2022年4月4日中科院生物物理研究所蔡华清课题组在《Nature Communications》杂志发表题为"The PripA-TbcrA complex-centered Rab GAP cascade facilitates macropinosome maturation in Dictyostelium"的研究论文,该论文揭示了巨胞饮体成熟过程中由Rab5、Rab7、PripA和TbcrA构成的Rab GAP信号级联通路调控巨胞饮体成熟和货物降解的分子机制。
巨胞饮(macropinocytosis)是细胞非选择性内吞胞外液体的过程。这一特殊的内吞行为在多种细胞类型中发生,例如阿米巴细胞利用其获取环境中的营养物质,免疫细胞利用其捕获抗原,神经细胞利用其内吞膜受体调节突触信号。巨胞饮也与许多疾病的发生相关,例如在神经退行性疾病中介导蛋白聚集体在细胞间的传递、被病原体利用入侵宿主细胞等。近年来的研究也发现,某些肿瘤细胞能够通过上调巨胞饮摄取蛋白质和脂肪酸等营养物质,从而在肿瘤微环境中维持生长优势。相比其他内吞过程,巨胞饮作用具有若干鲜明的特点。首先,巨胞饮提供了一种内化大量溶质和膜的途径,巨胞饮体的直径一般在0.2~5微米,远大于被广泛研究的网格蛋白形成的内吞泡的大小。其次,巨胞饮不依赖包被蛋白或固体颗粒模板,而是由肌动蛋白驱动质膜发生形变,进一步形成内吞囊泡。这些巨胞饮过程特性的背后蕴藏复杂的调控机理,然而目前对巨胞饮体形成和成熟的分子机制还知之甚少。
为了解析巨胞饮体成熟过程的分子机制,蔡华清课题组利用模式生物Dictyostelium discoideum细胞开展研究。首先观察了Rab小GTP酶的动态变化,发现巨胞饮体在从质膜上分离后会依次被Rab5和Rab7标记。有趣的是,在从Rab5标记的早期巨胞饮体向Rab7标记的晚期巨胞饮体转变的过程中,Rab7并不像经典模型中描述的那样是从胞质中被招募到囊泡结构上的。相反,当Rab5标记的早期巨胞饮体进入细胞中约20-30秒后,大量Rab7标记的晚期巨胞饮体会定位在Rab5囊泡结构的周围并与之融合。这一现象表明巨胞饮体成熟过程中Rab5向Rab7的转化依赖晚期巨胞饮与早期巨胞饮体的融合。
进一步通过对在Rab5向Rab7的转化阶段特异定位于巨胞饮体上的蛋白的筛选,发现了由包含PH结构域的一个蛋白和包含RabGAP结构域的一个蛋白所组成的蛋白复合体,并将这两个蛋白分别命名为PripA和TbcrA。结合延时荧光成像、酵母双杂交和一系列生化实验,证明PripA分别与早期巨胞饮体上的PI(3,4)P2和晚期巨胞饮体上的Rab7结合,为两种巨胞饮体膜结构之间建立链接。与此同时,PripA招募TbcrA,而后者作为Rab5的GAP促进Rab5-GTP的水解,从而保证在晚期巨胞饮体与早期巨胞饮体融合的过程中Rab5被及时失活。pripA或tbcrA基因的缺失会抑制Rab5的失活,并阻碍巨胞饮体的成熟和内吞货物的降解。此外,研究发现PripA-TbcrA复合体在细胞吞噬细菌和酵母等微生物的过程中也发挥类似的功能,从而促进吞噬体的成熟。
综上所述,该研究揭示了Rab5、Rab7和PripA-TbcrA复合物以Rab GAP级联(Rab GAP cascade)的形式调控巨胞饮体成熟的分子机制。在该调控机制中,处于信号通路下游的Rab7通过膜融合的方式被富集到巨胞饮体上,Rab7再通过招募GAP蛋白抑制通路上游的Rab5的活性,从而确保巨胞饮体成熟过程中Rab小GTP酶转化的方向性,使得细胞能高效地处理巨胞饮内吞的货物,进而及时获取维持细胞生长和增殖的营养物质。这项研究提示我们不同来源的内吞囊泡加工方式的多样性,为深入探究细胞内吞过程的分子机制奠定了重要的基础。
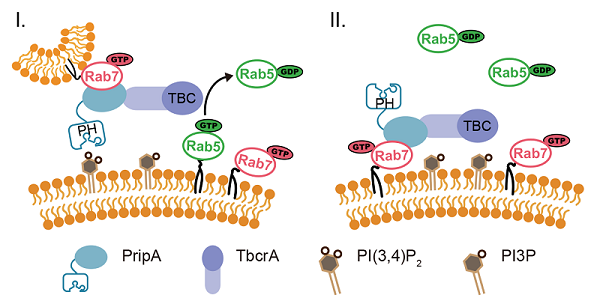
图. Rab5、Rab7和PripA-TbcrA复合体构成的Rab GAP信号级联通路调控巨胞饮体成熟
中国科学院生物物理研究所博士生涂慧为本文的第一作者,蔡华清研究员为本文的通讯作者。该研究得到国家自然科学基金委、科技部和中科院先导项目等的经费支持。
文章链接:https://www.nature.com/articles/s41467-022-29503-1
(供稿:蔡华清研究组)
附件下载: