
范祖森课题组发现胸腺嘧啶诱导成纤维细胞转化为中性粒细胞
2022年3月17日,中国科学院生物物理研究所范祖森课题组在《Cellular & Molecular Immunology》杂志发表了题为"Induction of functional neutrophils from mouse fibroblasts by thymidine through enhancing Tet3 activity"的文章,首次报道了代谢物胸腺嘧啶小分子可以诱导成纤维细胞向中性粒细胞的命运转化。
中性粒细胞由骨髓造血干细胞向下游分化形成,是人体内循环白细胞中数量最多的一群,也是机体抵御入侵病原体的第一道防线。向炎症部位聚集时,中性粒细胞通过胞吞作用、脱颗粒释放抗菌分子、形成胞外陷阱等主要效应来清除病原体。此外,中性粒细胞也通过分泌细胞因子来参与宿主免疫反应。已有临床数据显示,中性粒细胞的先天缺陷,如Kostmann综合征所致中性粒细胞缺乏症患者,会因重度感染引发败血症、感染性休克和多器官衰竭,从而导致致命的后果。而当前,针对这种状况临床仍然主要依靠经验性的抗生素治疗。粒细胞集落刺激因子或粒细胞巨噬细胞集落刺激因子的免疫治疗,和从健康供者获得供体粒细胞进行异体细胞治疗虽可使感染和败血症的发生率减低,但这些细胞成分产品具有可能的感染传播,输血反应和人类白细胞抗原同种异体免疫等风险,其应用大大受到限制。近年来再生医学的发展,让由自体诱导解决细胞来源问题成为可能。
体细胞重编程技术发展到今天,通过导入命运决定的关键转录因子组合,除可将终末分化的细胞逆转为诱导性多能干细胞(iPS)外,在特定的条件下,还能够实现由终末分化的成纤维细胞或B细胞向神经元、心肌细胞、肝细胞、红细胞等单一细胞谱系的直接转分化,从而规避了iPS细胞应用的潜在风险。小分子化合物组合诱导重编程和命运转化的方案具有结构稳定、便于时间和浓度的精确可控等优势,较之转录因子外源基因的导入更适用于未来的临床应用。
本研究发现,代谢物胸腺嘧啶小分子可以诱导成纤维细胞向中性粒细胞的命运转化。诱导形成的中性粒细胞(iNeu)具备粒细胞谱系的典型形态和表达谱特征,以及中性粒细胞的功能,能够正常诱导粘附、迁移及吞噬细菌。我们进一步通过转分化过程的表达谱测序分析及荧光示踪,证明了胸腺嘧啶诱导了成纤维细胞向中性粒细胞的直接转分化,并不经过iPS或造血干祖细胞阶段。经过iNeu细胞长期多次移植的受体鼠造血系统维持正常,体内未见肿瘤发生,初步证明了iNeu应用于体内的安全性。我们进一步发现,胸腺嘧啶的下游代谢产物干预了细胞的TCA循环,促进了细胞内α-酮戊二酸的积累,从而提高了Tet3双加氧酶DNA去甲基化活性,增强下游Cebpδ及 Rfx1转录因子的表达,决定细胞向粒细胞谱系的转分化。我们的发现为体外获得中性粒细胞用于感染性疾病及粒细胞减少症等疾病的治疗提供了实验依据。
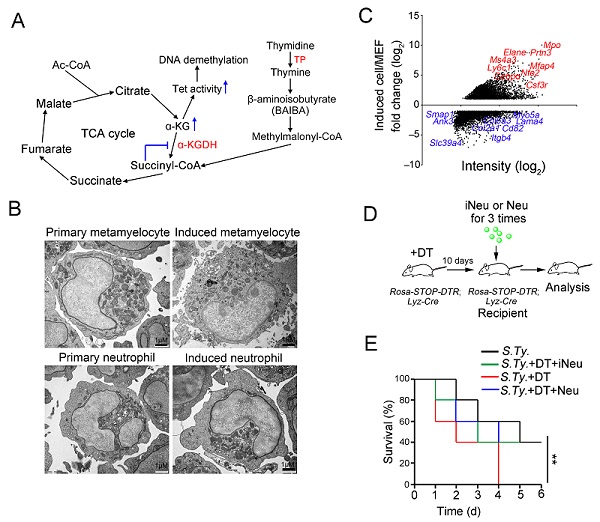
图1. 胸腺嘧啶促进成纤维细胞向中性粒细胞转化。(A)分子机制示意图。(B)iNeu具有原代粒细胞谱系典型形态。(C)iNeu高表达原代中性粒细胞特征基因。(D-E)在沙门氏菌感染中,iNeu移植提高受体鼠的存活率。
中国科学院生物物理研究所叶步青副研究员、田勇研究员及范祖森研究员为本文的共同通讯作者,副研究员叶步青、博士研究生杨柳柳、博士后刘本宇、博士生刘念及助理研究员范东东为并列第一作者。该研究得到国家自然科学基金、科技部重点研发计划、北京市自然科学基金和中科院先导专项的经费支持。
文章链接:https://www.nature.com/articles/s41423-022-00842-9
(供稿:范祖森研究组)
附件下载: