
赵岩课题组解析GPI转酰胺酶复合物结构并揭示其催化机制
糖基磷脂酰肌醇(GPI)是一类由甘露糖、葡萄糖胺、磷酸乙醇胺和肌醇磷脂组成的复杂糖脂。它可以与一些蛋白质的羧基端共价相连,将其锚定在细胞质膜外小叶上发挥生物学功能。这类的蛋白质被称为糖基磷脂酰肌醇锚定蛋白(GPI-AP)。在人体中,至少有150种蛋白质被鉴定为GPI锚定蛋白,广泛分布在各种类型的细胞中;这些GPI锚定蛋白参与很多生物学过程,包括膜相关酶活性(PLAP、Phospholipase B、Aspartic proteinase等)、细胞信号转导(CD55、CD59和钙通道调控亚基α2δ1等)、细胞粘附(OPCML、CD56等)和抗原呈递(Thy-1、CD14、CD52等)等。GPI锚定蛋白生物合成过程的异常通常引发多种疾病,例如阵发性夜间血红蛋白尿、智力障碍和癫痫发作等。
GPI锚定蛋白的生物合成是一种广泛存在于所有真核生物中的蛋白质翻译后修饰类型,并且参与该修饰过程的生化反应都是保守的,包括三个主要步骤:(1)在内质网膜上合成GPI分子;(2)在GPI转酰胺酶(GPIT)的作用下, GPI-AP前体蛋白(ProGPI-AP)的羧基端(C端)信号肽被切除与GPI分子共价相连,形成GPI-AP;(3)GPI-AP经过进一步加工、成熟过程,通过高尔基体转运至细胞膜上。GPI转酰胺酶复合物是GPI锚定蛋白生物合成第二步的关键催化酶,由五个亚基组成,包括 PIGK、PIGU、PIGT、PIGS和GPAA1。目前,已经报道了近30个与GPIT复合物相关的突变,这些突变会引发神经发育缺陷、先天性发育不良等诸多疾病。多年以来,GPIT复合物发挥催化活性的结构基础一直没有得到揭示。
2022年02月15日,中国科学院生物物理研究所赵岩课题组在《Nature Structural & Molecular Biology》期刊发表题为"Structure of human glycosylphosphatidylinositol transamidase"的文章,首次解析了人源糖基磷脂酰肌醇转酰胺酶的3.1 Å高分辨率结构;同时,研究者还通过对绿色荧光蛋白GFP进行改造,利用CRISPR/Cas9基因编辑技术、流式细胞术以及共聚焦显微成像技术等,验证了该酶的催化活性位点及发挥催化活性的重要氨基酸残基。
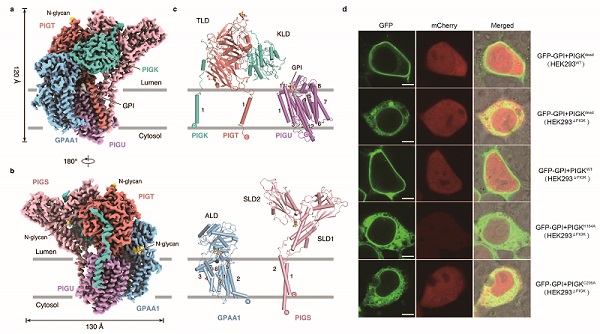
图1:a-b. GPIT复合物的整体结构;c. GPIT复合物单个亚基的结构;d. 利用共聚焦显微成像技术验证GPIT复合物的活性。
GPI转酰胺酶的整体结构形似一只跳跃的海豚。在跨膜螺旋区,PIGU亚基分别与GPAA1、PIGK、PIGT、PIGS的跨膜螺旋相互作用,从而介导复合物的组装;在内质网腔中,催化亚基PIGK的可溶结构域分别与其他亚基通过二硫键、静电相互作用以及范德华力相互作用,形成稳定的复合物结构并且行使催化功能。利用CRISPR/Cas9基因编辑和共聚焦显微成像等技术,研究者构建了GPIT体内活性分析体系。结合突变实验,研究者证实了PIGK亚基中的第206位半胱氨酸C206、164位组氨酸H164以及58位天冬酰胺N58,形成了催化三联体。H164可以通过吸引C206巯基基团中的质子,使后者亲核攻击蛋白质底物中的酰胺键,通过硫酯键形成GPIT与ProGPI-AP的中间体。GPI分子头部的游离氨基继而通过亲核攻击中间体,取代形成GPI-AP。而N58则通过氢键作用稳定了H164的构象,从而保障催化反应高效的发生。此外,在催化三联体下方的细胞膜内,PIGU、PIGT、PIGS、GPAA1亚基的跨膜螺旋构成了一个开放的空腔。研究者在这个空腔中发现了一个形似GPI分子核心区的密度,提示该空腔可能是底物分子GPI的结合位点。
有趣的是,通过结构分析发现GPIT复合物可以与另外一个由6根跨膜螺旋组成的未知蛋白相互作用。质谱分析的结果显示E3泛素连接酶RNF121在纯化的GPIT复合物样品中丰度较高,同时具有6根跨膜螺旋。RNF121的AlphaFold2预测结构较好的吻合三维电势密度图。通过进一步体外pull-down实验也证实了E3泛素连接酶RNF121与GPIT复合物有直接的相互作用。研究人员推测E3泛素连接酶RNF121通过与GPIT复合物相互作用,从而监控GPIT复合物的组装,对组装不完全的或者发生错误组装的复合物进行修饰,从而使其进入降解途径。
中国科学院生物物理研究所赵岩研究员为本研究论文的通讯作者。生物物理所博士研究生张宏薇、苏嘉伟和李斌为本文的共同第一作者。生物物理所朱冰研究员实验室的熊俊、刘泽奇在CRISPR/Cas9基因编辑技术方面提供了有力的帮助。中国科学院生物物理研究所生物成像平台、质谱平台为本研究提供了设备和技术支持。本研究获得了中国科学院战略性先导科技专项(B类)、国家自然科学基金委员会项目的资助。
文章链接:https://www.nature.com/articles/s41594-022-00726-6
(供稿:赵岩研究组)
附件下载: