
生物物理所在新冠病毒原位结构研究方面取得进展
近日,《美国国家科学院院刊》(PNAS)在线发表了中国科学院生物物理研究所孙飞课题组联合王祥喜课题组等在新冠病毒原位结构研究方面的最新成果。该工作利用冷冻电镜断层重构技术,研究了β-丙内酯灭活的新冠病毒表面spike蛋白的原位结构特征,揭示了其融合后构象状态下纳米级分辨率的精细原位结构,包括跨膜区、融合活性六螺旋区、糖基化位点等。此外,还首次发现并深入研究了其特殊的寡聚化状态特征,提示了病毒感染中融合孔的潜在形成机制。这些结果进一步丰富了人类对于新冠病毒原位结构和感染机制的认识,为病毒入侵药物的开发提供了重要参考依据。
目前,新冠病毒的感染仍在全球蔓延,死亡人数不断增多,给人类健康和全球经济都造成巨大威胁。了解新冠病毒的结构特征,尤其是精细的原位结构,对于疫苗和药物的开发都极为重要。新冠病毒表面布满了刺突状的spike蛋白,主要负责识别人体表面受体从而介导病毒感染,是疫苗和药物的主要设计靶点之一。孙飞课题组与合作团队的前期研究发现,靶向spike蛋白融合后构象状态的多肽制剂可以有效阻断新冠病毒感染,但是这个靶点的准确原位结构特征尚不为人知。因此,他们利用冷冻电镜断层重构技术,收集了β-丙内酯灭活的新冠病毒粒子的连续倾转数据。数据处理结果发现,病毒表面存在有数量相当的prefusion状态和postfusion状态的spike蛋白,其中postfusion状态的蛋白更倾向于表现出与病毒膜垂直的状态。虽然每个病毒上postfusion的spike蛋白数目不太多,但是统计数据发现很多蛋白之间的距离小于20nm,显示出一定程度的寡聚行为。
通过进一步的子体积平均计算,研究人员得到了10.9埃分辨率的postfusion状态的spike原位结构。结构中可以看到蛋白跨膜区的位置,也揭示了药物靶点六螺旋结构域的准确原位结构。结构中共观察到7个糖基化位点,其密度的强弱与相应位点糖基化的程度相关。通过将蛋白结构与断层重构体相互对照,研究人员推测出两种不同的spike寡聚化机制,即平行排列的状态可能是通过相邻蛋白之间HR2结构域的交换来寡聚,而分叉排列的状态可能是通过FP结构域或者TM结构域的相互结合来寡聚。这些寡聚行为都将显著增强spike蛋白在病毒膜上的局部丰度,有利于病毒感染中融合孔的形成。这些原位结构信息可以为靶向spike的抗病毒药物和疫苗的开发提供重要参考数据。
中科院生物物理所朱赟副研究员、孙飞研究员和王祥喜研究员为论文共同通讯作者,博士生台林华、朱国梁和杨闽楠为并列第一作者。该研究得到了饶子和院士的指导和支持,得到中科院战略性先导科技专项、国家自然科学基金委和科技部重点研发项目支持。该工作所有电镜数据收集工作在生物物理所生物成像中心完成。
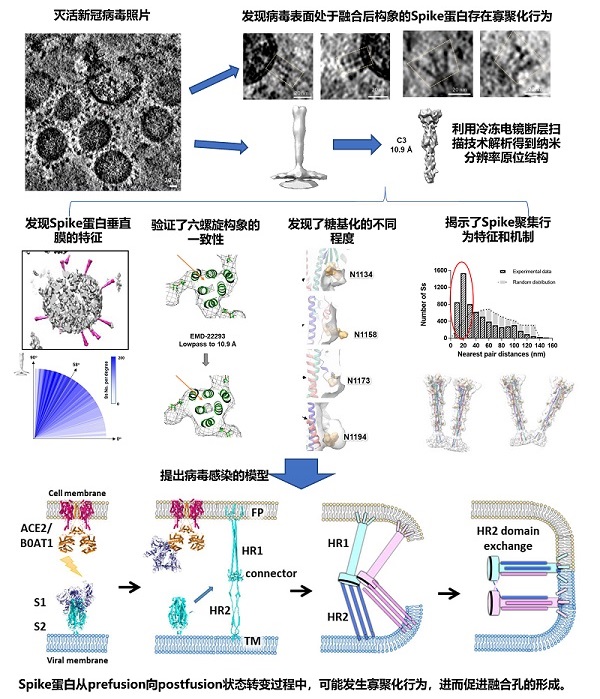
新冠病毒spike蛋白postfusion状态的原位结构研究
文章链接:https://www.pnas.org/content/118/48/e2112703118
(供稿:孙飞研究组)
附件下载: