
李新建团队揭示葡萄糖转运蛋白GLUT1通过棕榈酰化修饰维持自身质膜定位促进胶质瘤的糖酵解和恶性进展
葡萄糖是人体细胞主要的供能物质,哺乳动物细胞通过糖酵解代谢通路将1分子葡萄糖转化为2分子丙酮酸并生成2分子ATP供细胞使用,随后丙酮酸被转运至线粒体,在线粒体基质中丙酮酸通过三羧酸循环以及偶联的电子传递链转化为二氧化碳和水,并产生大量的ATP分子。此外,在胞浆中丙酮酸也能在乳酸脱氢酶的催化下转化为乳酸并排出胞外。1924年德国生理学家Otto Warburg首次提出假说认为健康细胞依靠线粒体中的三羧酸循环途径产生ATP为自身供能,而肿瘤细胞即使在氧气充足的条件下仍然只使用产能效率相对较低糖酵解为自身供能,此现象被称为Warburg效应。目前大量的研究结果支持Warburg效应是导致肿瘤细胞快速增殖、转移以及获得耐药性的原因之一。葡萄糖依赖膜转运蛋白介导的跨膜扩散进入细胞,葡萄糖膜转运蛋白家族成员数量超过10个,其中GLUT1在人体组织器官中广泛表达,是主要的葡萄糖跨膜转运蛋白。恶性肿瘤的有氧糖酵解异常活跃,消耗大量的葡萄糖,保持葡萄糖的高效跨膜运输是维持恶性肿瘤细胞快速增殖的必要条件。
蛋白S-棕榈酰化修饰发生在半胱氨酸残基,由棕榈酸末端羧基与半胱氨酸的巯基连接而成,2002年Roth AF和Lobo S等人报道了在酵母中该反应由酰基转移酶催化完成。目前已发现在哺乳动物细胞中表达的酰基转移酶有23种,主要的生物学功能是调控胞内蛋白的膜定位、跨膜蛋白的胞内转运、蛋白之间相互结合以及蛋白稳定性。值得关注的是,棕榈酸作为长链脂肪酸具有亲脂特性,能够嵌入真核细胞的磷脂双层膜,导致携带棕榈酰化修饰的蛋白分子更容易锚定在细胞膜,该特性决定了棕榈酰化修饰对依赖于外膜定位发挥功能的蛋白分子(例如营养物质/代谢产物的膜转运蛋白、生长因子受体蛋白和G蛋白偶联受体蛋白)具有调控作用。
2021年10月7日,中国科学院生物物理研究所李新建研究团队在《Nature Communications》杂志上在线发表了题为 “DHHC9-mediated GLUT1 S-palmitoylation promotes glioblastoma glycolysis and tumorigenesis” (DOI: 10.1038/s41467-021-26180-4) 的研究论文。该研究揭示了葡萄糖转运蛋白GLUT1的半胱氨酸207位点携带棕榈酰化修饰,将该位点(Cys207)突变为丝氨酸能破坏GLUT1的质膜定位,说明GLUT1的质膜定位依赖于Cys207棕榈酰化修饰。进一步的分子机制研究发现DHHC9是负责GLUT1棕榈酰化修饰的酰基转移酶,敲除DHHC9能够消除GLUT1棕榈酰化修饰,进而破坏GLUT1的质膜定位。恶性胶质瘤依赖DHHC9介导的GLUT1棕榈酰化修饰维持高水平的葡萄糖摄入能力、糖酵解能力、克隆形成能力以及裸鼠移植瘤的细胞增殖能力。与正常的星型胶质细胞比较,胶质瘤细胞更依赖于DHHC9介导的GLUT1棕榈酰化修饰维持高水平的葡萄糖摄入能力,提示DHHC9-GLUT1信号轴是胶质瘤的代谢弱点,设计特异性靶向DHHC9的小分子抑制剂有望实现特异性靶向胶质瘤。此外,通过对胶质瘤手术切除组织标本的免疫组化染色,研究人员还发现了DHHC9的蛋白表达水平与GLUT1的质膜定位呈正相关性,并且DHHC9的高表达和GLUT1的质膜定位都是胶质瘤病人的不良预后指标。
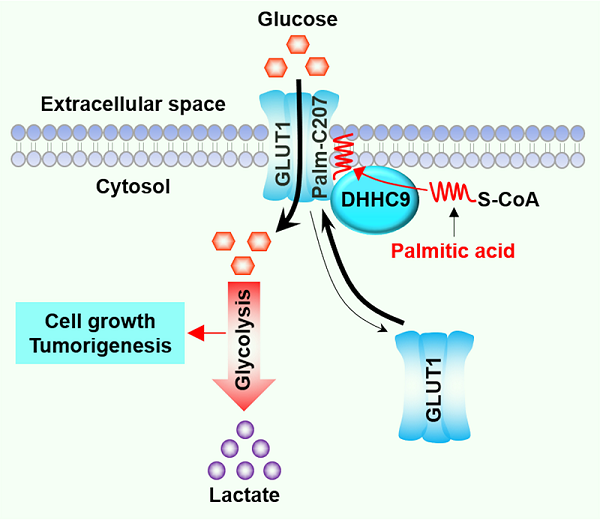
图. GLUT1通过DHHC9介导的棕榈酰化修饰维持自身质膜定位,促进胶质瘤的糖酵解和恶性进展。
中国科学院生物物理研究所李新建研究员为该论文的唯一通讯作者,中国科学院生物物理研究所博士后张振兴、博士生李欣、博士生杨帆和博士后陈超为该论文的共同第一作者,南京医科大学第一附属医院尤永平教授为该论文研究提供了胶质瘤组织标本和病例的预后随访数据。该研究得到了国家自然科学基金委、中国科学院和国家重点研发计划的经费支持。
文章链接:https://www.nature.com/articles/s41467-021-26180-4
(供稿:曾益新/李新建研究组)
附件下载: