
卜鹏程课题组和合作者合作研究揭示促癌基因NEAT1抑制白血病发生和发展
2021年10月5日,中国科学院生物物理研究所卜鹏程课题组和解放军总医院第五医学中心胡亮钉教授团队合作在《Advanced Science》杂志上发表题为"Cytoplasmic NEAT1 Suppresses AML Stem Cell Self-Renewal and Leukemogenesis through Inactivation of Wnt Signaling"的文章,首次发现实体瘤中被认为是促癌基因的长链非编码RNA NEAT1(Nuclear Enriched Abundant Transcript1),通过抑制急性髓系白血病(Acute Myeloid Leukemia, AML)自我更新,抑制AML的发生和发展。研究人员发现定位于旁斑中的NEAT1从细胞核穿梭到细胞质中,与Wnt通路接头蛋白DVL2和E3泛素化连接酶Trim56结合,通过促进DVL2降解,抑制Wnt信号通路,进而抑制AML干细胞的自我更新。
AML是髓系前体细胞中系列染色体易位和基因突变导致的,AML患者间存在极强的异质性,临床上针对不同的AML发病机理采取不同的治疗方法,但仍有许多AML亚型尚无有效的靶向药物,且已有的靶向药物对发病机理复杂的患者疗效不显著,研究AML调控新机制,探索靶向不同类型AML的普适靶点是AML研究中亟待解决的问题。
LncRNA NEAT1是细胞核中亚细胞结构旁斑的重要组成元件,具有NEAT1_1(3.7Kb)和NEAT1_2(23Kb)两种亚型,目前关于NEAT1_2的研究很多,作为旁斑的骨架,在旁斑的构建和mRNA的出核中发挥着重要的作用,在肝细胞肝癌、胃癌、结直肠癌和神经胶质瘤等实体瘤中均被认为是促进肿瘤细胞增殖、转移和耐药的促癌基因。然而,卜鹏程课题组意外的发现,NEAT1在AML骨髓细胞中的表达显著低于正常骨髓细胞,且NEAT1能有效抑制FLT-ITD3,MLL-AF9和HOXA9/Meisl三种AML亚型的发展。进一步研究发现,细胞质中的NEAT1_1通过调控Wnt信号通路,抑制AML干细胞的自我更新、促进细胞分化。
研究人员首先通过分析TCGA和GEO数据库,意外发现,NEAT1在AML细胞中的表达显著低于正常血液细胞,且与AML患者的复发期呈正相关,即NEAT1表达越低的患者复发期越短。为了探究NEAT1不同亚型在AML中的表达情况,研究人员根据NEAT1_1和NEAT1_2的序列特征,即二者具有相同的5'端和不同的3'端序列,设计并合成了分别靶向总NEAT1和只靶向NEAT1_2的检测探针,通过与解放军总医院第五医学中心胡亮钉教授团队合作收集了大量的健康人群,初治和复发AML患者的骨髓样本,检测证实了NEAT1_1和NEAT1_2均在健康、初治和复发AML患者的骨髓细胞中的表达依次降低,且在AML干细胞中的表达明显低于非干细胞。有意思的是,研究人员在RNA FISH染色中发现与NEAT1_2限制性定位于细胞核不同,部分NEAT1定位于细胞质中,且在非干细胞中的表达显著高于干细胞,推测这部分定位于细胞质中的是NEAT1_1。研究人员通过进一步核质分离检测证明NEAT1_1在AML细胞中发生细胞核到细胞质的转移,且在分化的AML细胞质中累积增多。体外AML细胞中敲低NEAT1_1促进细胞成克隆和增殖,抑制细胞分化和凋亡。研究人员分别利用两例初治和复发患者的AML细胞构建了PDX模型,结果发现无论是初治还是复发患者来源的AML细胞,敲低NEAT1_1均能促进AML细胞在骨髓、脾脏和外周血中的浸润,显著缩短小鼠的存活时间。不仅如此,研究人员还分别构建了FLT-ITD3,MLL-AF9和HOXA9/Meisl三种亚型的AML小鼠,发现NEAT1_1通过抑制骨髓中AML细胞自我更新和增殖,抑制AML细胞向外周组织浸润,进而抑制AML的发展。研究人员进一步研究发现,AML干细胞分化过程中,转录因子C/EBPβ表达上调和核定位蛋白NAP1L1的表达下调是调控NEAT1_1出核的关键。机制研究表明,细胞质中的NEAT1_1与Wnt信号通路的接头蛋白DVL2和E3泛素化连接酶Trim56结合,降解DVL2,抑制Wnt信号通路的激活。
该研究发现了实体瘤中的促癌基因NEAT1在AML中具有抑癌功能,揭示了NEAT1_1出核新机制,为AML靶向治疗提供理论依据。
中国科学院生物物理研究所卜鹏程研究员和解放军总医院第五医学中心胡亮钉教授为本文通讯作者,卜鹏程课题组助理研究员晏荟文和博士研究生王智为并列第一作者。该研究得到科技部、国家自然科学基金委和中科院的经费支持。
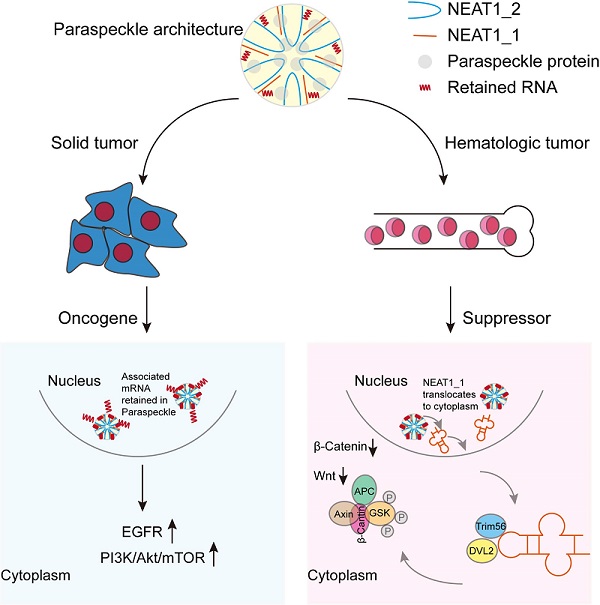
图:NEAT1在实体瘤和AML中通过不同的作用机制,分别发挥促癌和抑癌功能
文章链接: https://onlinelibrary.wiley.com/doi/10.1002/advs.202100914
(供稿:卜鹏程研究组)
附件下载: