
神经导向信号通路下游分子MICAL2PV通过抑制隧道纳米管形成参与调控肺癌细胞的线粒体转运
2021年6月6日,《EMBO Reports》期刊在线发表了分子神经生物学研究组的研究论文"MICAL2PV suppresses the formation of tunneling nanotubes and modulates mitochondrial trafficking",报道了神经导向信号通路下游分子MICAL2PV通过抑制隧道纳米管(TNT)形成参与调控肺癌细胞的线粒体转运。
肺癌是世界范围内最常见的恶性肿瘤,也是导致癌症相关死亡的最重要原因。根据世卫组织公布的2020最新全球癌症数据,我国新发癌症人数和癌症死亡人数均位居全球第一,其中肺癌排在新发和死亡人数第一位。虽然肺癌筛查和治疗已取得重大进展,但是随着人口老龄化导致的恶性肿瘤发病率显著上升,肺癌患者的5年生存率仍在10%左右。深入理解肺癌致病机理、确定新的分子靶标,对肺癌的早期诊断、指导治疗和预后评估都具有重要意义。
MICAL(Molecule Interacting with CasL)家族蛋白在神经系统中广泛表达,参与调节神经系统发育和/或再生。近年来发现,MICAL家族在肿瘤进展和转移中有重要作用。其中MICAL2是MICAL蛋白家族成员之一,在乳腺癌、胃癌等多种肿瘤的进展中发挥作用。MICAL2通过可变剪接产生两种剪接异构体, MICAL2PVa和MICAL2PVb(简写为MICAL2PV),并且其表达水平与肿瘤进展相关。作为细胞骨架调节蛋白,MICAL2能解聚F-actin;而F-actin的聚合参与形成细胞间交流方式TNT(Tunneling nanotube)。TNT在肿瘤进展及耐药中的作用均有报道,这提示MICAL2可能通过调节TNT形成从而影响肿瘤进展。
研究组前期发现,在人正常肺组织或肺癌样本中,MICAL2的主要表达形式为MICAL2PV亚型,且MICAL2PV在肺癌患者样本中下调;小鼠体内成瘤实验发现,下调MICAL2PV促进肿瘤生长,提示其在肺癌中可能发挥抑癌基因的作用。在本文的研究中,通过在两种肺癌细胞中设计实验,发现MICAL2PV通过其MO结构域介导F-actin解聚从而抑制TNT形成;而下调MICAL2PV表达可显著增加TNT形成,并且增强TNT介导的线粒体转运。免疫荧光染色和活细胞成像结果显示,下调MICAL2PV促进了线粒体从核周浸润到皮层细胞骨架。MICAL2PV通过与线粒体运动相关蛋白Miro2相互作用,抑制其定位到线粒体。而Cytochalasin B解聚F-actin后明显抑制线粒体浸润,促使线粒体在核周聚集,提示下调MICAL2PV后引起的F-actin聚合作用同样参与了线粒体浸润。将化疗药物处理的细胞与健康细胞共培养,发现下调MICAL2PV可通过促进TNT形成参与肺癌细胞耐药。这些研究结果揭示了MICAL2PV作为肺癌细胞中MICAL2的主要存在形式,通过MICAL2PV-Miro2轴,参与调控肺癌细胞的线粒体亚细胞分布和TNT介导的线粒体转运,从而影响肺癌进展和耐药。
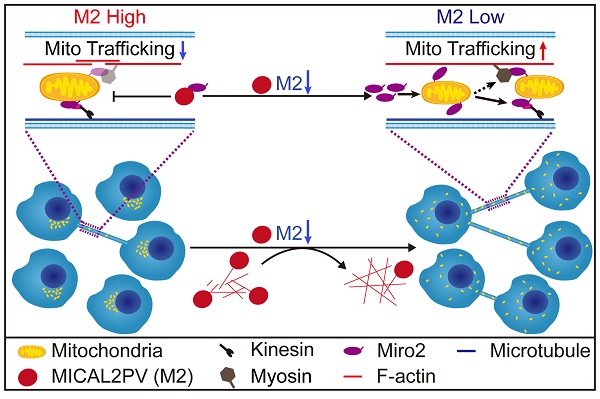
图1. MICAL2PV抑制TNT形成和TNT介导的线粒体转运。下调MICAL2PV促进F-actin聚合,增加TNT形成和细胞间线粒体运动和分布。
该研究为理解肺癌的进展、化疗耐药和复发,提供了新的视角,同时也为发现新的肺癌分子靶标提供重要研究基础。
中国科学院生物物理研究所脑与认知科学国家重点实验室的博士生王飞为本文的第一作者,朱笠研究员和美国西北大学医学院吴瑛教授为共同通讯作者。该研究获得国家重点研发计划和国家自然科学基金项目资助。
文章链接:https://www.embopress.org/doi/full/10.15252/embr.202052006
(供稿:分子神经生物学研究组)
附件下载: