
王江云/钟芳锐、吴钰周教授课题组在生物催化交叉偶联-光驱动卤代芳烃羟化脱卤酶的设计方面获得重要进展
2021年1月7日,JACS期刊发表了王江云课题组与华中科技大学钟芳锐、吴钰周教授课题组题为"Biocatalytic Cross-Coupling of Aryl Halides with a Genetically Engineered Photosensitizer Artificial Dehalogenase" 的研究文章。文中报道了基于该课题组前期设计的一种可以基因编码的光敏蛋白质,进一步实现了光敏蛋白质吸收光能驱动卤代芳烃羟化脱卤反应的功能。
苯酚类结构普遍存在于药物、农药、材料以及天然产物中,已经报道了多种不同的策略合成此类结构,其中最具吸引力的方法为卤代芳烃直接羟基化,目前已经报道了钯、铜等金属作为催化剂,强碱作为羟基源,对卤代芳烃直接进行羟基化。水作为一种绿色环保的溶剂,具有极大的潜力作为羟基来源,目前虽然已报道了以水作为羟基来源的卤代芳烃羟基化研究,但此领域仍存在极大的开发价值,尤其是发展与酶催化水相体系相结合的体系。
王江云研究员课题组前期研究发现通过使用基因密码子扩展技术可以将非天然氨基酸插入荧光蛋白(PSP),从而改造发色团生成具有高还原活性的物种,进一步在蛋白表面特定位置引入三联吡啶镍配合物,可以驱动二氧化碳光还原(Nat. Chem., 2018;Acc. Chem. Res.,2019),在这些工作中PSP蛋白表现出优异的光化学性质。基于此,中科院生物物理研究所王江云研究员课题组与华中科技大学钟芳锐、吴钰周教授课题组合作设计对引入PSP-NiII(bpy)人工光敏金属蛋白作为催化剂进行酚类物质的合成进行探索,期望将PSP-NiII(bpy) 人工光敏金属蛋白进一步应用于光敏蛋白-金属协同催化小分子转化体系。
通过使用对溴苯甲醛作为底物分子,在水相体系中探究了此光敏蛋白催化芳基卤化物脱卤与水进行交叉偶联构建酚类物质的活性,一系列条件优化,发现PSP-NiII(bpy)可以成功实现温和条件下卤代芳烃与水的交叉偶联构建酚类。进一步底物扩展实验表明反应体系对不同取代的底物分子均以优异的产率得到相应苯酚类产物,同时也可以进一步用于卤代芳烃脱卤构建C-N键。瞬态光谱实验表明,在任何条件下均未观察到PSP自由基信号,因此反应过程中可能没有产生PSP自由基,DIPEA仅仅作为碱促进产物的形成,PSP光敏蛋白吸收光能后通过能量转移促进激发态NiII复合物的形成,随后通过还原消除以及氧化加成循环实现酚类产物的合成。通过在PSP蛋白表面不同位点引入Cys突变体,进一步探究其发色团与镍催化中心之间距离对反应活性的影响,实验结果表明,当两者之间距离太大或者太小均对反应活性存在较大影响,两者之间存在最适反应距离。
研究开发了一种温和条件下光敏金属酶催化交叉偶联反应的策略。这种人工光敏酶可以有效整合PSP蛋白以及NiII(bpy)配合物,并且可以通过精确调控两者之间的距离,进而提高反应催化效率,其可以将芳基卤化物高效转化为苯酚类物质,同时对于高价值C-N键的形成也具有很大潜力。
该工作由中国科学院生物物理研究所和华中科技大学合作完成。生物物理研究所核酸生物学重点实验室王江云研究员、刘晓红研究员和华中科技大学钟芳锐教授、吴钰周教授为本文的共同通讯作者,华中科技大学和中国科学院生物物理研究所联合培养研究生付雨和中国科学院生物物理研究所研究生黄健为本文共同第一作者。该研究得到科技部、国家自然科学基金委和中科院的经费支持。感谢生物物理所蛋白质科研平台提供的帮助。
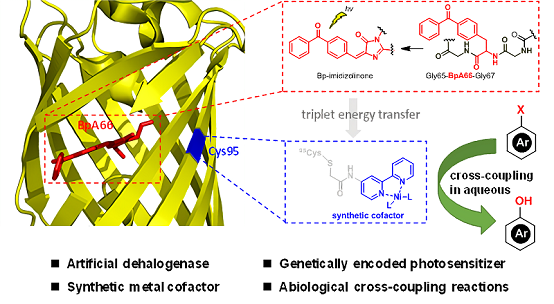
光驱动还原脱卤酶的设计
文章链接:https://pubs.acs.org/doi/10.1021/jacs.0c10882
(供稿:王江云研究组)
附件下载: