
张宏课题组发现肌醇多磷酸激酶IPMK通过抑制转录因子TFEB的液-液相分离调控自噬活性
2020年12月7日,《Developmental Cell》杂志发表了中国科学院生物物理研究所张宏课题组题为"Inositol polyphosphate multikinase inhibits liquid-liquid phase separation of TFEB to negatively regulate autophagy activity"的研究论文,该文揭示了肌醇多磷酸激酶IPMK通过调节转录因子TFEB的液-液相分离,进而调控自噬活性和溶酶体产生的机制。
细胞自噬(autophagy)是指细胞通过形成双层膜的自噬体包裹部分细胞质,如受损伤的细胞器或错误折叠的蛋白质等,并运输至溶酶体进行降解的过程。自噬对细胞应对各种应激条件以及维持稳态平衡至关重要,但对自噬在多细胞生物发育过程中的调控机制还知之甚少。张宏课题组建立了秀丽隐杆线虫(C. elegans)为研究多细胞生物自噬活性调控的遗传模型,并通过筛选发现ipmk-1突变显著提高机体的自噬活性。ipmk-1编码肌醇多磷酸激酶IPMK的同源物。在哺乳动物细胞中敲除IPMK也显著提高自噬活性,并促进溶酶体的产生和功能。IPMK调控自噬-溶酶体通路的活性依赖于IPMK的细胞核定位,但并不依赖其酶活性。
进一步研究发现,IPMK对自噬活性的调控依赖于转录因子TFEB的活性。敲减TFEB能够抑制IPMK敲除细胞中异常增强的自噬活性和增多的溶酶体。TFEB是调控自噬-溶酶体通路相关基因的关键转录因子,目前已发现多种信号通路通过影响TFEB的磷酸化水平,来控制其入核转运进而调控自噬。出乎意料的是IPMK敲除不影响TFEB的磷酸化和入核水平。这项新研究发现TFEB蛋白在细胞核内可以通过液-液相分离形成具有液态特征的凝聚体结构参与转录调控。IPMK通过与TFEB直接相互作用抑制了TFEB的液-液相分离,IPMK敲减导致核中的TFEB凝聚体结构增多,TFEB凝聚体与转录中介体Mediator以及下游基因LAMP1 mRNA的共定位也增多。这些结果表明IPMK通过调控TFEB的液-液相分离进而调控自噬-溶酶体活性。
该研究首次揭示了TFEB通过液-液相分离形成的凝聚体在介导基因转录中的重要功能。另外还阐释了IPMK作为细胞核内分子伴侣直接调控TFEB的相分离,从而控制其转录活性这一新的机理。同期《Developmental Cell》发表了奥地利维也纳大学Sascha Martens教授的题为"Out of Phase: How IPMK inhibits TFEB"的评论文章,指出该工作揭示了一个新的自噬调控的机制,并开启了多个重要的研究方向。
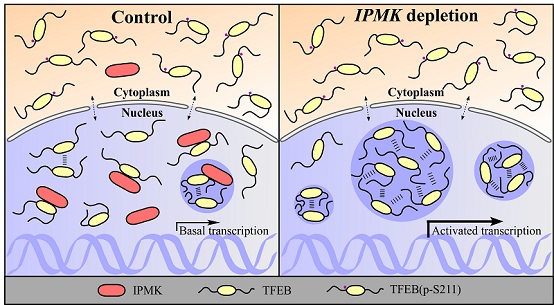
图1. IPMK通过抑制转录因子TFEB的液-液相分离而调控自噬活性
文章链接:https://www.sciencedirect.com/science/article/pii/S1534580720308005?via%3Dihub=
(供稿:张宏研究组)
附件下载: