
周政/朱平合作揭示开放核小体导致染色质松散的分子机制
常规核小体的结构包括一个由四种组蛋白H2A、H2B、H3、H4组装而成的蛋白核心,一条在组蛋白核心上缠绕1.6圈,长度为147 bp的双链DNA。核小体结构非常稳定,对DNA组成和组蛋白修饰的改变均不敏感。组蛋白变体可以改变核小体和染色质结构调控基因转录,迄今为止测定的所有单核小体结构中,构象改变最大的CENP-A核小体就是组蛋白H3变体核小体,结构显示CENP-A核小体包含的DNA为121bp,但其蛋白核心结构变化不大。组蛋白H2A变体H2A.B和H2A.Z.2.2分别在精原细胞和人脑组织中特异表达,在精子发生、转录起始、RNA剪切等过程中具有重要功能。H2A.B和H2A.Z.2.2形成开放的核小体结构,并"破坏"染色质结构,导致染色质松散。但是这种开放的核小体极不稳定,难以获得高精度结构。
2020年10月19日,《THE EMBO JOURNAL》杂志在线发表了中国科学院生物物理研究所周政课题组与朱平课题组合作的题为"Structural basis of nucleosome dynamics modulation by histone variants H2A.B and H2A.Z.2.2"的研究论文。该研究利用冷冻电镜解析了分别包含组蛋白变体H2A.B和H2A.Z.2.2的核小体结构,阐明了H2A变体蛋白调控核小体动态性和染色质结构开放的分子机制。
为了稳定H2A.B核小体,研究人员重组表达了PARP1的DNA结合结构域肽段PARP1-DBD,并将其加入H2A.B核小体用以制备冷冻电镜样品。生化及电镜结果表明PARP1-DBD降低了核小体DNA末端波动性,但不影响核小体结构。在此基础上研究人员解析了分辨率为2.8 ?的H2A.B核小体结构。
与常规核小体相比,H2A.B核小体的蛋白核心发生明显的构象变化,部分结构元件缺失。H2A.B-H2B二聚体的间距增大,导致缠绕DNA的螺距增大,核小体变得更厚。同时,组蛋白核心上缠绕的DNA长度大幅减少了三分之一,仅为103 bp,导致其仅能缠绕蛋白核心1.2圈。研究人员同时解析了H2A.Z.2.2核小体的3.9 ?电镜结构, 结构显示H2A.Z.2.2蛋白核心的构象变化与H2A.B核小体类似,但是该核心缠绕的DNA约为125 bp。Mnase酶切和八聚体组装结果表明H2A.B与H2A.Z.2.2的C末端存在一个由6个氨基酸残基组成的八聚体组装调控序列(ROF,regulating-octamer-folding),H2A.Z.2.2独特的ROF序列可以显著提高H2A.Z的酶促交换反应效率。总之,该研究解析了迄今发现的最为开放的核小体结构,并揭示了H2A.B和H2A.Z.2.2调控核小体结构变化与染色质动态性的分子机制。
周政研究员和朱平研究员为本文的共同通讯作者。朱平组助理研究员周旻和周政组博士后(特别研究助理)戴霖昌为共同第一作者。李成珉博士、博士研究生史刘歆和黄艳博士也参与了该项研究。生物物理所生物成像中心为该研究提供了冷冻电镜研究设备和技术支持。该研究得到了国家自然科学基金、科技部国家重点研发计划和中国科学院战略性先导科技专项(B类)等项目的资助。
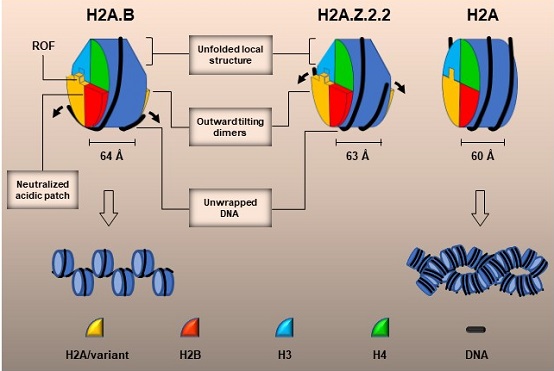
图1 变体核小体结构与结构变化示意图
文章链接:https://www.embopress.org/doi/full/10.15252/embj.2020105907
(供稿:周政研究组)
附件下载: