
高璞组和邓红雨组合作揭示疱疹病毒抑制宿主mRNA出核转运的分子机制
病毒在与宿主长期的博弈过程中,进化出了多种机制来对抗和逃避宿主的抗病毒反应。其中,通过干预宿主的mRNA出核转运过程,进而阻止宿主细胞建立合适的抗病毒环境,是其中的一个重要策略。比如,甲型流感病毒NS1蛋白和水疱性口炎病毒的M蛋白均被发现可以广谱抑制宿主mRNA出核转运。2016年的一项研究发现,γ疱疹病毒(如卡波西肉瘤相关病毒KSHV和鼠γ疱疹病毒MHV68)编码的ORF10蛋白,可以通过与宿主mRNA转运复合物Rae1-Nup98相互作用,特异性抑制部分宿主mRNA的出核转运。值得一提的是,ORF10是疱疹病毒中第一个被发现可以抑制宿主mRNA出核转运的毒力蛋白,也是目前报道的第一个能选择性抑制特定mRNA转运的病毒蛋白。然而,ORF10与Rae1-Nup98复合物互作的结构基础,以及ORF10发挥抑制功能的分子机制,目前仍不清楚。
2020年10月8日,中科院生物物理所高璞课题组和邓红雨课题组合作在PNAS上发表题为“Molecular mechanism underlying selective inhibition of mRNA nuclear export by herpesvirus protein ORF10”的研究工作,该研究综合运用生物化学、结构生物学及细胞生物学手段,解析了γ疱疹病毒ORF10与宿主mRNA转运复合物Rae1-Nup98的互作细节,确认了ORF10的RNA结合能力及其重要功能,并揭示了ORF10选择性抑制mRNA出核转运的作用机理。
研究人员利用昆虫细胞表达系统,制备了状态良好的ORF10-Rae1-Nup98三元复合物样品,并成功解析了该复合物2.5Å分辨率的晶体结构。结构分析发现,ORF10与Rae1-Nup98复合物存在两个主要的互作界面。在这两个互作界面中,ORF10两个高度保守的氨基酸L60和M413贡献了重要的疏水相互作用。通过Co-IP、体外Pull-down、GFP报告基因的表达测定、GFP-mRNA的核质分布测定、RNA FISH成像等多种生化细胞实验, 研究人员明确了L60和M413对维持ORF10与Rae1-Nup98的相互作用、以及对维持ORF10的mRNA出核转运抑制功能都至关重要。
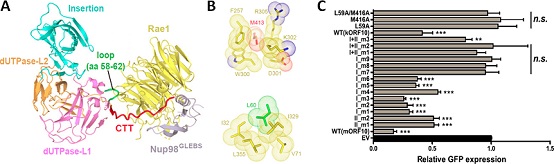
ORF10-Rae1-Nup98复合物结构、互作细节、及突变体对GFP报告基因表达的影响
有意思的是,虽然ORF10占据了Rae1-Nup98复合物自身的RNA结合口袋,但是ORF10-Rae1-Nup98三元复合物却依然保持着足够强的RNA结合能力。研究人员推测ORF10本身可能也具备与RNA的直接结合能力。的确,后续生化实验证实了ORF10可以直接结合RNA。通过对ORF10表面的正电荷聚集区进行系统突变,确定了其结合RNA的位点,并发现ORF10与RNA的互作对其发挥抑制mRNA出核转运的功能非常关键。
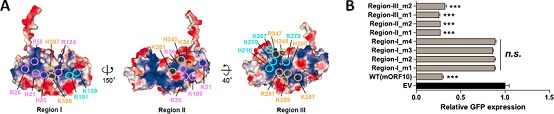
ORF10表面电荷分布,以及突变体对GFP报告基因表达的影响
综上,作者解析了γ疱疹病毒ORF10蛋白与宿主mRNA出核转运复合物Rae1-Nup98的三元复合物结构,明确了两个重要的病毒-宿主互作界面及关键氨基酸,发现了ORF10直接结合RNA的能力及其对抑制宿主功能的重要性。另外,此项工作还意外发现,完全不同的病毒蛋白(如γ疱疹病毒的ORF10蛋白和水疱性口炎病毒的M蛋白)都可以结合到Rae1-Nup98的RNA结合口袋,这提示了该位点的重要性,也为设计新的抗病毒疗法提供了思路。
高璞研究员和邓红雨研究员为本文的共同通讯作者。高璞组的副研究员冯菡和邓红雨组的助理研究员田华彬为共同第一作者。生物物理所俞洋研究员参与了RNA实验的指导工作。国家蛋白质科学研究(上海)设施BL17B1线站、BL18U1线站及BL19U1线站工作人员为X射线晶体学衍射数据收集提供了及时有效的支持。该工作得到了科技部、基金委和中科院相关经费的资助。
文章链接:https://www.pnas.org/content/early/2020/10/07/2007774117
媒体报道:https://mp.weixin.qq.com/s/8HL8EQ3gc9JXxvfoqD_kFg
(供稿:高璞研究组)
附件下载: