
高璞组揭示病原菌介导的新型泛素化及去泛素化的催化调控机制
2020年6月2日,《Nature Communications》杂志在线发表了高璞课题组的研究论文"Insights into catalysis and regulation of non-canonical ubiquitination and deubiquitination by bacterial deamidase effectors"。该工作解析了来源于高致病性嗜肺军团菌(Legionella pneumophila)的新型泛素化酶MavC与底物蛋白UBE2N及泛素分子的复合物结构,并同时解析了MavC及其同源蛋白MvcA与负调控因子Lpg2149的两种复合物结构。结合大量生化和细胞实验,阐明了这种新型泛素化修饰系统催化和调控的分子机制。
蛋白质泛素化修饰是真核细胞最重要的翻译后修饰之一。经典的泛素化修饰需要通过E1-E2-E3三酶级联反应来催化完成,而近期鉴定的两类L. pneumophila效应蛋白(SidE和MavC)却可以通过不依赖E1-E2-E3的全新方式催化宿主蛋白的泛素化修饰(图1)。高璞课题组曾于2018年在《Cell》杂志报道了SidE家族蛋白催化反应的结构和分子机制,而此项最新工作则主要是围绕MavC家族蛋白展开研究。
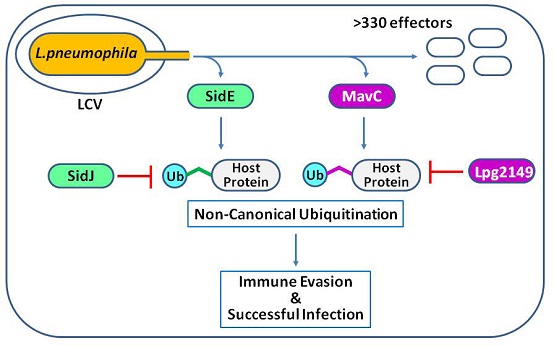
图1:病原菌编码的两种新型泛素化修饰系统
MavC所在基因组簇可编码三种效应蛋白:Lpg2147(MavC),Lpg2148(MavC paralog A或MvcA)和Lpg2149。MavC和MvcA均可以催化泛素分子的脱氨反应(Ub-Q40转变为Ub-E40),而Lpg2149则可以抑制这两种脱氨酶的活性。近期的研究表明,MavC还可以特异性泛素化修饰宿主蛋白UBE2N,进而抑制UBE2N的正常E2功能,从而抑制NF-κB通路的活化。有趣的是,尽管MvcA与MavC非常类似,但MvcA却不能催化UBE2N泛素化。
研究人员利用MavC催化制备了泛素化修饰的UBE2N(UBE2N~Ub),并解析了MavC与UBE2N~Ub复合物的晶体结构(图2a)。该结构直接揭示了MavC与UBE2N以及Ub的互作界面,并表明MavC利用同一个活性中心催化脱氨反应及泛素化反应。MvcA与MavC的序列和结构比较表明,MvcA的Insertion结构域中并不保守存在能够与UBE2N结合的关键氨基酸,这也解释了为何MvcA不能稳定结合游离状态的UBE2N,以及为何不能催化UBE2N的泛素化修饰。这些基于结构所得的结论,也进一步通过生化和细胞实验获得了验证。
出乎意料的是,MavC和MvcA还具备去泛素化酶的活性,可以特异性去除MavC介导的UBE2N泛素化修饰(图2b)。由于MvcA比MavC的去泛素化活性更强,因而在实际感染中MavC和MvcA很可能分别发挥泛素化酶和去泛素化酶的功能。这一发现表明MavC可以利用同一个活性口袋来催化脱氨、泛素化以及去泛素化三种酶学反应,同时鉴定了MavC是目前为止第一个能够同时添加和去除同一类泛素化修饰的酶。
研究人员进一步解析了MavC+Lpg2149复合物和MvcA+Lpg2149复合物的晶体结构(图2a)。与游离状态下的晶体结构呈现紧密二聚体不同,Lpg2149以单体形式与MavC或MvcA相互作用。由于Lpg2149和Ub占据相似的结合位置,说明Lpg2149可以直接干扰Ub与MavC/MvcA的相互作用。功能实验表明,Lpg2149确实可以同时抑制脱氨、泛素化及去泛素化。有意思的是,游离状态的MavC本身就具备Lpg2149的结合构象,而MvcA则需要发生较大的构象变化来实现与Lpg2149的结合。进一步的结合实验表明,MavC-Lpg2149的亲和力比MvcA-Lpg2149强约50倍,这与结构分析是一致的。
综上,本研究较为完整的阐明了Mavc介导的新型泛素化修饰的催化和调控机制,既有助于理解病原与宿主相互博弈的多样性机制,也可为新型抗细菌疗法的设计提供思路。
高璞研究员为通讯作者,其课题组副研究员王勇和博士生展琪为共同第一作者。高光侠研究员及其课题组副研究员王新路指导并开展了细胞实验。上海光源为晶体数据收集提供了支持。生物物理所平台杨福全研究员和王继峰博士为质谱分析提供了帮助,陈媛媛博士为ITC实验提供了帮助。此研究得到国家自然科学基金委、科技部及中科院的经费支持。
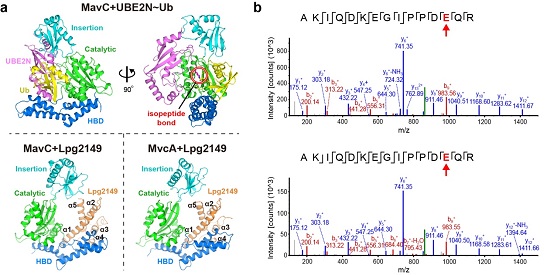
图2:a, MavC+UBE2N~Ub、MavC+Lpg2149和MvcA+Lpg2149三种复合物的晶体结构;b, MavC(上)和MvcA(下)催化UBE2N~Ub去泛素化的切割位点。
媒体报道:http://blog.sciencenet.cn/blog-3423233-1236257.html
文章链接:https://www.nature.com/articles/s41467-020-16587-w
(供稿:高璞研究组)
附件下载: