
饶子和与胡俊杰课题组
2020年5月7日,《Journal of Cell Biology》杂志在线发表了饶子和院士课题组与胡俊杰课题组合作的研究论文,题为“Structural insights into G domain dimerization and pathogenic mutation of OPA1”。该研究解析了线粒体内膜融和蛋白OPA1的最小GTP酶结构域(MGD)在结合GDP和氟化铍状态下的晶体结构,阐明了OPA1的GTP酶结构域二聚化的分子基础,以及突变诱发疾病的原因。
线粒体是由双层膜包被的细胞器,在细胞内持续发生融合和分裂以维持其正常功能。线粒体内膜融合与外膜一样,其缺陷导致线粒体DNA的丢失,小鼠胚胎致死,而人的OPA1突变还导致视神经萎缩症等遗传疾病。饶子和与胡俊杰团队前期合作阐明了线粒体外膜融合蛋白Mitofusin(MFN)介导膜拴连和融合的机制,今年年初又报道了酵母的线粒体内膜融合蛋白Mgm1的结构,提出了内膜融合的初步模型。近日,生物大分子国家重点实验室孙飞课题组利用冷冻电镜解析了OPA1在膜上装配的结构(https://doi.org/10.7554/eLife.50294),并提出了OPA1诱导膜形变的分子机理。不过,OPA1仍是发动蛋白(Dynamin)超家族中仅存的一个没有高分辨率结构的成员。
饶子和院士和闫利明博士的团队解析了人源OPA1-MGD的结构,发现其单体构象与膜裂解蛋白Dynamin-1的GG(GTPase-GED)片段很相似,并形成了依赖核苷酸的二聚体。胡俊杰课题组通过酶活测定、体外多聚体分析和膜结合等生化实验,以及细胞内的线粒体形态回补实验验证了结构的发现。此外,OPA1-MGD的N端存在一个类似卷曲螺旋的二聚化区段,能介导不依赖核苷酸的二聚化。OPA1的这两种二聚化在维持线粒体形态中均起到重要作用。
胡俊杰研究员是本文的通讯作者。胡俊杰课题组的赵京华、饶子和课题组的余彩婷和闫利明为本文的共同第一作者。该研究得到国家重点研发计划、国家自然科学基金和中科院B类先导专项的支持。
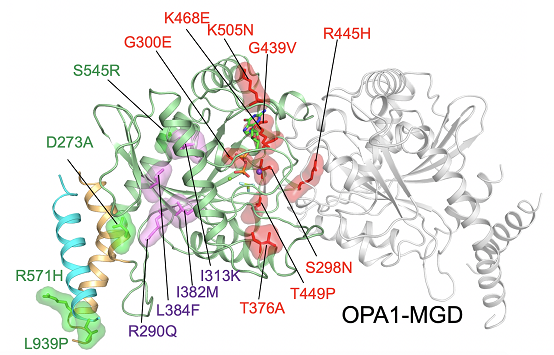
OPA1-MGD的二聚体结构及疾病突变位点图
文章链接:https://doi.org/10.1083/jcb.201907098
(供稿:胡俊杰研究组)
附件下载: