2017年6月7日,国际著名期刊Nature Communications杂志发表了中科院生物物理研究所阎锡蕴院士团队与清华大学生命科学学院孟安明院士团队合作的题为“The signaling receptor MCAM coordinates apical-basal polarity and planar cell polarity during morphogenesis”的研究论文。
该研究利用斑马鱼作为研究模型,在对CD146(MCAM)在发育中的功能研究中发现:CD146可以同步激活NFAT转录反应和JNK的活性,使细胞的顶底极性和前后极性协调地同步建立、从而在时空上相偶联。该研究还提示,具有催化活性的成型素类分子,可能是顶底极性建立的真正的空间诱因;CD146介导囊泡转运所形成的极性分布,可能是细胞极性形成的最初的启动因子。此外,该研究还发现:CD146的缺失,不仅会导致斑马鱼的胚胎器官Kupffer囊腔的发育异常,而且会引发后续的、全身性的器官左右不对称分布异常。
细胞极性是指细胞中,特定胞质组分在一定空间方向上不对称分布。细胞极性在细胞迁移、器官形成、以及内脏器官的不对称分布的建立等众多生命过程中起着关键性的作用。2010年,“胚胎期不对称现象是如何确定的?”,被美国的Science杂志社列为125个人类将致力于研究解决的、最具挑战性的科学问题之一。而且,细胞极性的异常与许多疾病(如癌症等)的状态有关。因此,揭示细胞极性形成的未解之谜,对于深入理解细胞极性参与的生理与病理进程具有普遍意义。
细胞极性包括垂直方向上的顶端-底端不对称极性和水平方向上的前端-后端不对称极性。在胚胎期器官发育的形态发生过程中,顶底极性常指导同类型细胞的精确排列,而前后极性常控制纤毛的生长方向。癌症的发生发展则常伴随着这两种细胞极性的消失以使癌细胞获得更强的运动能力。这两种完全不同的极性的建立,分别由两套不同的蛋白质来执行和完成。解码细胞这两种极性的建立,是否偶联以及偶联的机制是生物学的一大挑战。但是,目前发表的相关论文都是对这两种细胞极性进行分别研究。
该成果为深入理解形态发生中的细胞的自组装过程——这一生命奥秘,提供了普遍的、规律性的解释;为攻克“胚胎期不对称建立的机制”——这一具有挑战性的科学问题,提供了全新的证据。而且,该研究为深入理解CD146分子在胚胎发育、血管新生、以及肿瘤转移过程中的功能,提供了机制性的解释。
文章连接
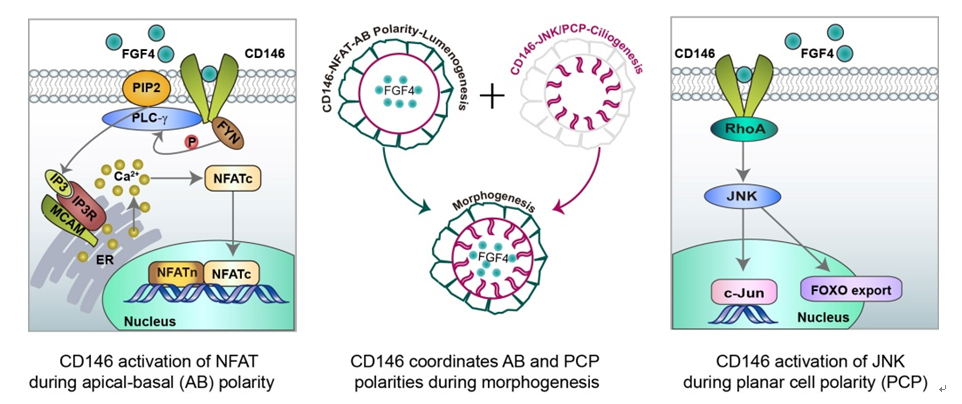
图示:CD146通过同步激活NFAT和JNK而使两种细胞极性在时空上相偶联
