2014年9月30日,《PNAS》杂志在线发表了阎锡蕴课题组在肿瘤药物靶向输送领域的最新成果。这是她们继发现纳米酶(Nature Nanotechnology 2007)并将其应用于肿瘤诊断(Nature Nanotechnology 2012)之后,又一次将纳米材料的新特性应用到肿瘤靶向治疗。
化疗是当前癌症病人首选的治疗方式,然而化疗中存在的主要问题是毒副作用大。如何提高药物的疗效、降低其副作用,一直是肿瘤药物研究的关键和难题。随着纳米科学的蓬勃发展,利用纳米技术改良药物的性状,使其精准地杀伤肿瘤细胞,减少对正常组织的损伤,是肿瘤靶向治疗的核心。为了获得具有主动靶向功能的药物载体,人们通常在纳米材料的表面修饰一些功能基团,如特异识别肿瘤的抗体等。然而,修饰过程不仅复杂、成本高、而且修饰后的载体分子容易聚集,造成产品不均一。另外,纳米材料的生物相容性差也是引起免疫系统识别和清除的重要原因。
阎锡蕴课题组依据人体天然铁蛋白独特的壳核结构,仿生合成了24 聚体铁蛋白纳米粒子,其外壳直径12nm,内腔为8nm能有效装载化疗药物阿霉素。铁蛋白纳米载体有3个突出的特点:(1)由人体天然蛋白质自组装而成的药物载体;(2)无需在其表面做任何修饰,即可直接识别并杀伤肿瘤;(2)动物实验结果表明,单剂量给药就能有效抑制结肠癌、乳腺癌及黑色素瘤的生长。与目前国际上唯一应用于临床的脂质体阿霉素纳米药物相比,疗效更好、存活率长而且毒副作用小。
这种新型药物载体不仅能够在肿瘤组织富集,而且还使肿瘤细胞内的药物浓度提高十倍,使阿霉素所致的心脏毒性降低七倍。进一步机制研究发现,铁蛋白载体结合肿瘤细胞膜上的转铁蛋白受体,是其靶向肿瘤的分子基础。另外,铁蛋白纳米粒子作为天然蛋白质,生物相容性好,不易引起机体的免疫排斥反应,因此毒性小。本文为天然蛋白纳米粒作为高效低毒的靶向载体的研究提供了新思路。
论文链接:http://www.pnas.org/content/early/2014/09/24/1407808111.abstract?sid=49f17b42-abfa-421e-a59a-f737be8d46c3(doi: 10.1073/pnas.1407808111)
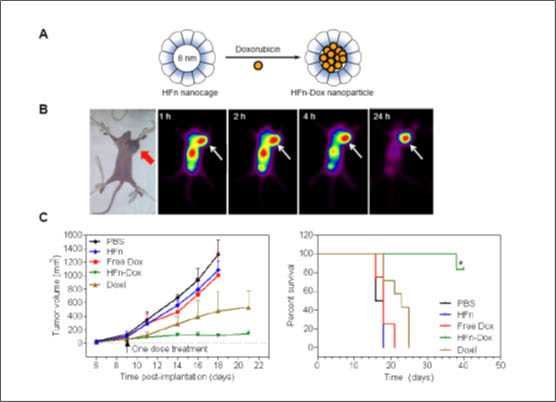
图1:铁蛋白纳米载体靶向输送抗癌药物(A)铁蛋白纳米载体装载抗癌药物;(B)携带抗癌药物的铁蛋白纳米粒精确靶向肿瘤;(C)装载抗癌药物的铁蛋白纳米粒有效治疗结肠癌,延长生存期。
供稿:阎锡蕴研究组
报道:科技处
