2016年12月15日,Molecular Cell 杂志在线发表了中科院生物物理研究所王艳丽课题组关于CRISPR-Cas系统的最新研究成果,文章标题为“C2c1-sgRNA Complex Structure Reveals RNA-Guided DNA Cleavage Mechanism”。
CRISPR-Cas系统由成簇且有规律间隔的短回文重复序列和它的相关蛋白(Cas)构成,它是原核生物中的由RNA介导的获得性免疫系统,其主要功能是抵御外来入侵的遗传物质。另外,CRISPR-Cas系统还被广泛用于基因组编辑,其中CRISPR-Cas9的使用范围最广泛。最近新发现的另一种Cas蛋白C2c1,有着与Cas9类似的功能。这不禁让人想到:C2c1是否也可以被开发成新的基因编辑工具?王艳丽课题组的这一工作或许可以给这个想法的实现提供一些新的理论基础。
在本研究中,课题组成员解析了结合有sgRNA的C2c1晶体结构。该结构显示C2c1由两个区域构成,分别是具有识别sgRNA功能的REC区域和具有核酸酶功能的NUC区域。sgRNA是由crRNA和tracrRNA人工嵌合而成,其中,crRNA结合在C2c1的中心孔道内,tracrRNA则被安置在C2c1外表面的凹槽中。有趣的是,通过进一步观察,课题组研究人员发现C2c1对应的sgRNA呈现出一种与Cas9对应的sgRNA或最近报道过的Cpf1所对应的crRNA显著不同的结构。受到这个新结构的提示,研究人员一方面分析了其他物种的C2c1所对应的sgRNA结构,另一方面缩短了该sgRNA的长度,并进行活性实验,这两方面的结果都初步验证了这种独特结构的真实性和有效性。此外,该研究还发现目的序列的单个碱基突变可以显著降低C2c1剪切活性,这表明C2c1对靶定的目的序列有极其严格的要求,这一研究结果有助于开发新的基因组编辑工具,降低基因编辑过程中的脱靶现象。
王艳丽课题组的刘亮(博士后)和陈鹏(研究生)分别为本文的第一作者和第二作者,该研究得到科技部、国家自然科学基金以及中国科学院战略性先导科技专项(B类)的资助,上海同步辐射光源为该研究提供了重要的技术支持。
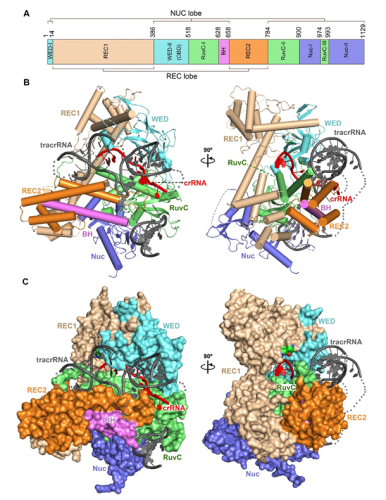
图注:AacC2c1-sgRNA复合物的整体结构。(A) AacC2c1蛋白各结构域的分布;(B 和C) 结合有sgRNA的C2c1晶体结构的正交视图,B图为卡通结构,C图为表面结构,其中sgRNA的crRNA部分用红色显示,tracrRNA部分用黑色显示。
