乙酰胆碱(acetylcholine)是人类发现的第一种神经递质。因其在"神经冲动的化学传递"中里程碑式的重要意义,该发现于1936年获得诺贝尔生理学或医学奖。乙酰胆碱是胆碱能神经元合成并利用的主要神经递质。当乙酰胆碱从神经末梢释放时,它能够结合并激活定位在突触前/后膜上的乙酰胆碱受体,诱导神经元的兴奋,介导并调控大脑中认知以及运动相关过程的信息传递。当乙酰胆碱在突触间隙完成信号传递后,乙酰胆碱酯酶会将其分解为醋酸盐和胆碱。游离的胆碱会进一步被定位在突触前膜上的高亲和力胆碱转运蛋白CHT1(high-affinity choline transporter 1)摄取,回收到突触前末梢中,再次参与乙酰胆碱的合成代谢循环。先前研究表明,CHT1介导的胆碱回收是乙酰胆碱合成的限速步骤。因此,CHT1的表达异常和功能障碍会诱发多种疾病,例如遗传性运动神经元病、肌无力综合征、动脉粥样硬化、抑郁症和阿尔兹海默病等。
CHT1(SLC5A7)是钠离子/溶质同向转运家族成员,借助细胞内外钠离子的电化学势,驱动胆碱的高亲和力跨膜转运。HC-3(hemicholinium-3)是选择性靶向CHT1的小分子药物,竞争性地抑制了CHT1介导的胆碱转运,被用作神经肌肉阻滞剂。然而,人们对CHT1识别胆碱的关键位点尚不明确,其构象变化的结构基础以及小分子HC-3对转运活性的抑制机制也有待阐明。
2024年4月8日,中国科学院生物物理研究所赵岩研究组在国际学术期刊《Nature Structural & Molecular Biology》上发表题为"Transport mechanism of presynaptic high-affinity choline uptake by CHT1"的研究论文。该研究利用单颗粒冷冻电镜技术,首次解析了CHT1在外向HC-3结合状态、内向无底物结合状态和内向胆碱结合状态的高分辨率结构;并借助放射性同位素示踪、底物摄取实验和分子动力学模拟等一系列实验方法,阐释了CHT1识别和转运胆碱的分子模型以及HC-3抑制转运活性的机制,并为新型CHT1靶向药物的开发提供了结构基础。
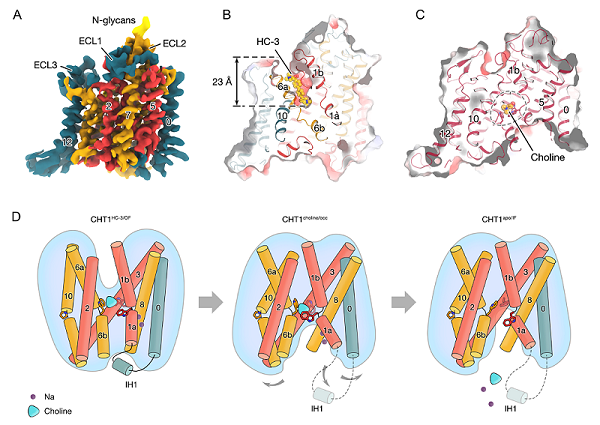
图:CHT1结合不同配体后处于不同的构象状态以及假定的底物转运机制图
在结合了HC-3的CHT1外向结构中(图A-B),HC-3呈现出棒状形态,并从外侧插入底物结合口袋,将蛋白锁定在外向开口状态。在内向胆碱结合状态下,CHT1的胞内口袋向内开放,胆碱仍然被色氨酸三联体稳定(图C)。在内向无底物结合状态下,色氨酸三联体口袋发生构象变化,胆碱向胞内溶剂侧暴露,进而导致胆碱从底物结合口袋中释放。
此外,胞内短螺旋IH1也是CHT1转运过程中发挥作用的重要元件(图D)。在外向的CHT1结构中,IH1螺旋参与维持了构象的稳定。当底物与CHT1结合,CHT1从外向转变到内向状态。此时,IH1螺旋被释放,暴露了CHT1的胞内口袋,促进了转运的发生。进一步实验表明,IH1螺旋缺失突变体完全丧失了底物转运活性,且无法从内向转变到外向状态。
中国科学院生物物理研究所赵岩研究员是该论文的通讯作者,生物物理所博士研究生邱云龙、高逸伟为共同第一作者。此外,北京望石智慧黄博和赵岩组白秦儒也为该研究提供了帮助。中国科学院生物物理研究所生物成像中心为该研究提供了设备和技术支持。研究工作得到科技创新2030-"脑科学与类脑研究"重大项目、国家重点研发计划、国家自然科学基金和中国科学院战略性先导科技专项的支持。
文章链接:https://doi.org/10.1038/s41594-024-01259-w
(供稿:赵岩研究组)
 附件下载:
附件下载: