2024年3月20日,中国科学院生物物理研究所孙飞研究组和大连化学物理研究所李国辉研究组在《Science Advances》杂志发表题为“In situ structural insights into the excitation-contraction coupling mechanism of skeletal muscle”的研究论文,该论文揭示了高等哺乳动物骨骼肌三联体介导兴奋-收缩偶联过程的原位结构基础。
在生物体内,骨骼肌的收缩与舒张是受神经系统控制的。神经系统传递来的化学信号经过一系列的转变与传递过程最后形成肌肉的机械收缩行为,这个过程被称为兴奋-收缩偶联。在骨骼肌中,肌细胞的细胞膜会内陷形成长而窄的膜性细管--横管,而横管通常会被两侧的终池夹在中间形成一种特殊的紧密结构称为三联体。在兴奋-收缩偶联过程中,横管膜上的二氢吡啶受体(dihydropyridine receptors,DHPR)负责感受沿着横管传递到肌细胞深处的电兴奋,并将信号传递给肌浆网膜上的钙离子通道蛋白--1型兰尼碱受体(ryanodine receptors type 1,RyR1),继而由RyR1释放出肌浆网中储存的钙离子;之后,钙离子会充当信号调控粗、细肌丝之间的相对滑动,引起肌肉的收缩与舒张。由此可知,三联体上的RyR1是整个兴奋-收缩偶联过程中传递兴奋信号的重要元件。2015年,颜宁研究组、施一公研究组与英国MRC的Sjors Scheres研究组合作,成功解析了兔源RyR1蛋白与其抑制蛋白FK506结合蛋白12(FKBP12)的复合体的3.8 Å高分辨率三维结构。2016年,北京大学基础医学部的尹长城研究组和孙飞研究组合作,在RyR1关闭态的基础上解析了钙离子激活的RyR1开放态4.2 Å分辨率的结构。然而,尽管 RyR1的高分辨率结构已经被解析,仍有一系列关于 RyR1功能的重要科学问题未被解决,包括 RyR1 在肌肉组织三联体中如何分布、如何发挥上下游信号传递作用、如何产生信号的协同效应等。尤其是关于RyR1与DHPR之间的作用方式,尽管研究者推测骨骼肌中的RyR1与DHPR之间存在紧密、直接的物理偶联,但该假说目前仍然缺少直接性的证据。
在该研究中,孙飞研究组基于前期工作基础,进一步结合组织原位制样方法和冷冻电子断层三维重构技术,系统性地表征了骨骼肌中三联体的精细原位结构。其中包括:解析了RyR1在骨骼肌16.7 Å分辨率的原位结构,发现在原位环境下RyR1与FKBP12和钙调蛋白(Calmodulin,CaM)紧密结合;解析了RyR1-DHPR超级复合体的原位结构,发现了两处连接密度,证实了RyR1与DHPR之间存在物理相互作用;发现RyR1在骨骼肌原位的“右手”对角镶嵌排列模式,四个DHPR形成的四联体以1:2的比例与RyR1结合;通过分子动力学模拟证明RyR1的“右手”对角镶嵌排列对于其协同钙释放的必要性,解释了相关遗传病理数据。这些研究结果为RyR1和DHPR之间的物理偶联提供了关键证据,为深入了解骨骼肌中的兴奋-收缩偶联分子机制提供了重要线索。
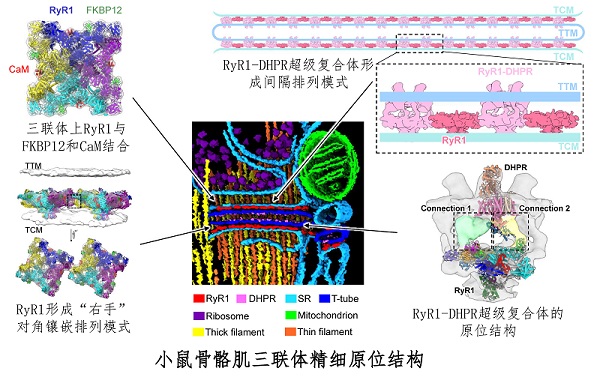
图. 小鼠骨骼肌三联体精细原位结构
中国科学院生物物理研究所孙飞研究员、朱赟研究员与大连化学物理研究所的李国辉研究员为本文的通讯作者。孙飞研究组已毕业的博士研究生徐嘉树、李国辉研究组的副研究员廖晨伊为本文的共同第一作者。北京大学基础医学部的尹长城教授为本研究提供了重要指导。该研究得到国家自然科学基金、国家重点研发计划、中国科学院战略性先导科技专项(B类)等项目的资助。样品制备、数据收集等工作得到了生物物理所蛋白质科学研究平台生物成像中心相关工作人员的大力支持和帮助。
文章链接:https://www.science.org/doi/10.1126/sciadv.adl1126
(供稿:孙飞研究组)
 附件下载:
附件下载: