近期,中国科学院生物物理研究所赵岩研究组在《EMBO Journal》杂志在线发表题为"Structural insight into the allosteric inhibition of human sodium-calcium exchanger NCX1 by XIP andSEA0400"的研究论文。这项研究通过冷冻电镜单颗粒技术重构出人源NCX1.3结合特异性抑制剂SEA0400的高分辨结构,揭示了XIP介导的自抑制机制和SEA0400的别构抑制机制。

钠钙交换蛋白(sodium-calcium exchange, NCX)属于SLC(Solute Carrier)家族和CaCA(Calcium/Cation Antiporter)超家族,是一种双向离子转运体,可以通过正向和反向转运方式,介导细胞内外Na离子和Ca2+的交换,对于维持细胞内钙稳态发挥重要作用。NCX参与体内多种生理过程,例如心肌兴奋-收缩耦联,血压调节、大脑长时程增强和神经递质分泌等。在多种心脑血管疾病中存在NCX功能异常,如缺血再灌注损伤、脑卒中、新生儿缺血缺氧性脑病等。因此,NCX结构的研究对于深入了解细胞内钙离子平衡调节机制、设计新型药物治疗策略以及探索与心血管疾病、神经系统疾病等相关的疾病机制具有关键意义。SEA0400是NCX1的选择性抑制剂并且更倾向抑制NCX的逆转运模式,该模式负责摄取细胞外Ca2+。然而,它对逆向转运模式而非正向转运模式选择性的分子基础仍然未知。理解这种分子基础对于合理开发特异性靶向NCX1逆模式的药理抑制剂至关重要,这在预防缺血/再灌注损伤和心力衰竭背景下的Ca2+超载和电功能障碍方面具有很大的治疗潜力。
通过冷冻电镜单颗粒技术解析的野生型NCX1.3的高分辨结构展示了其多个结构域的组装方式,包括两个调控性钙离子结合结构域(CBD1和CBD2)与离子转运跨膜结构域(TMD)。其中CBD1深入胞浆,而CBD2位于细胞质膜表面附近。CBD1和CBD2形成首尾串联结构,并形成约126°的夹角。TMD通过一个短螺旋与CBD2相连,位于跨膜螺旋中部的离子结合位点暴露向细胞内侧,因此可以判断出当前解析的结构为内开构象。
在CBD2和TMD之间的凹槽中观察到了交换抑制肽(the exchanger inhibitory peptide,XIP)的密度。之前的功能研究表明,XIP可以抑制NCX的活性并导致其失活,但其具体抑制机制一直不清楚。进一步的结构分析显示,XIP通过阻止门控螺旋TMs1/6的构象变化,将NCX稳定在内向构象并阻止其转变为外向构象,从而抑制NCX的转运活性。在结构中观察到了与XIP结合相关的关键相互作用,通过点突变及全细胞电生理实验,发现破坏这些相互作用会使XIP介导的失活被减弱。
细胞质Ca2+不仅作为NCX的底物,还通过与细胞内结构域CBD1和CBD2的结合来调节NCX的活性。CBD1含有四个Ca2+结合位点。CBD2中Ca2+结合位点的数量由其互斥的外显子A和B决定。含有外显子A的CBD2有两个Ca2+结合位点,而含有外显子B的CBD2缺乏Ca2+结合位点。NCX1.3含有外显子B,尽管NCX1.3的CBD2无法与Ca2+结合,结构分析显示CBD2与外显子A的潜在Ca2+结合位点紧邻XIP结合位点。在NCX1.3的结构中,CBD2表现出负电荷的静电表面,这有助于与带正电的XIP区域结合。而Ca2+与含外显子A的CBD2结合将中和这种负电势,从而减少XIP区域的结合亲和力,进而可能导致XIP介导的失活减少甚至完全消除,这是胞内Ca2+调控的机制。
选择性抑制剂SEA0400主要阻断NCX1,对NCX3几乎没有影响。在解析的结构中,它结合到TM2ab周围的一个变构结合位点,该位点大多数残基是保守的,除了一个苯丙氨酸在NCX3中被亮氨酸取代,功能实验进一步证实了这个残基在亚型选择性中的关键作用,为合理设计亚型特异性药物提供了坚实的基础。TM2ab与底物离子的结合和转运相关,SEA0400通过抑制TM2ab的构象转变来发挥抑制作用。此外,XIP与TM1-2 loop之间的相互作用也维持了TM2ab的特定构象,这对SEA0400的变构结合至关重要。钙成像功能实验也显示,XIP对于NCX对SEA0400的敏感性至关重要。进一步结构分析发现在逆向转运模式下,高浓度的细胞内Na+促进了XIP与TMD和CBD2的相互作用,导致NCX1.3的失活,而这一过程还稳定了SEA0400的变构结合口袋。这些发现揭示了XIP和SEA0400协同抑制NCX1.3,以及SEA0400在逆向转运模式下选择性地靶向NCX1.3的分子基础。
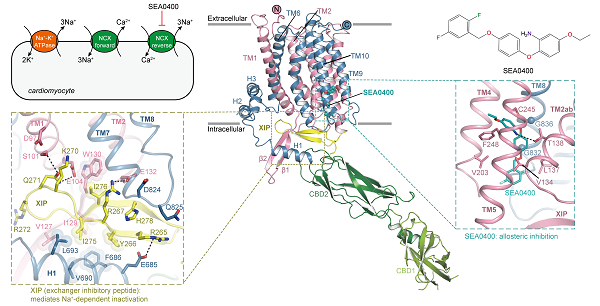
图:人源NCX1.3的结构和别构抑制机制
中国科学院生物物理所研究所赵岩研究员为本文通讯作者,中国科学院生物物理研究所特别研究助理董艳丽、博士研究生于卓亚和博士研究生李悦为论文共同第一作者,此外,北京望石智慧黄博,赵岩组白秦儒、高逸伟、陈琦浩、何玲莉,首都医科大学附属北京朝阳医院李娜也为本研究提供了帮助。清华大学的肖百龙课题组提供了钙成像实验的指导。冷冻电镜数据和钙成像实验数据收集得到中国科学院生物物理研究所蛋白质科学研究平台生物成像中心的技术支持。本研究得到科技创新2030"脑科学与类脑研究"重大项目、中国科学院战略性先导科技专项(B类)、国家自然科学基金项目、国家重点研发计划项目、中国博士后科学基金、中国科学院青年创新促进会等项目的资助。
文章链接: https://www.embopress.org/doi/full/10.1038/s44318-023-00013-0
(供稿:赵岩研究组)
 附件下载:
附件下载: