在真核细胞分裂过程中,染色质结构的重新建立对于维持基因组完整性和表观遗传信息传递至关重要。DNA复制一方面破坏母链DNA的亲本核小体,另一方面新生核小体必须在DNA子链上重建。染色质组装因子CAF-1是一种在进化过程中保守的异源三聚体组蛋白伴侣复合物,负责将新合成的H3-H4组蛋白装配到子链DNA上,完成从头装配的核小体组装的第一步,即形成一个由DNA缠绕H3-H4四聚体组成的核小体组装中间态Tetrasome(四聚小体)。
由于CAF-1与最基本生物学事件DNA复制高度耦联,因此缺少CAF-1的结构信息严重制约了人们对核小体从头装配机制的了解。CAF-1复合物是组蛋白伴侣研究方向中公认的难啃硬骨头,由于其主要亚基柔性很大、结合组蛋白构象不均一,分子量偏小(复合物稳定核心不到150 kDa),以至于用X射线晶体学和冷冻电镜技术来获得其高分辨率三维结构都充满了挑战。从1989年发现CAF-1至今30多年过去,国际上仅报道了约30 Å低分辨率的酵母Caf-1复合物负染电镜结构,无法提供相互作用细节,导致其中许多关键问题长期得不到解答。许瑞明课题组长期深耕于组蛋白伴侣的结构机理研究,先后揭示了组蛋白伴侣HJURP/DAXX特异识别组蛋白变体CENP-A/H3.3的结构机理(Genes & Dev 2011; NSMB 2012),解析了Asf1调控组蛋白乙酰化修饰的分子机制(Cell 2018),阐明了双组蛋白伴侣sNASP-ASF1与Hat1乙酰化酶协同传递与修饰组蛋白的分子机理(Genes & Dev 2021; Genes & Dev 2022)。课题组经过10多年的摸索与优化,最终在CAF-1的结构与功能研究上取得了重要突破。
2023年8月25日,中国科学院生物物理研究所许瑞明课题组联合本所李国红、朱冰课题组,在《Science》杂志在线发表了题为"Structural insights into histone binding and nucleosome assembly by chromatin assembly factor-1"的研究长文,报道了人源染色质组装因子CAF-1、CAF-1与组蛋白H3-H4及核小体组装中间态Di-tetrasome等复合物一系列近原子分辨率三维结构,揭示了CAF-1结合组蛋白并介导右手螺旋核小体组装中间态形成的结构基础。
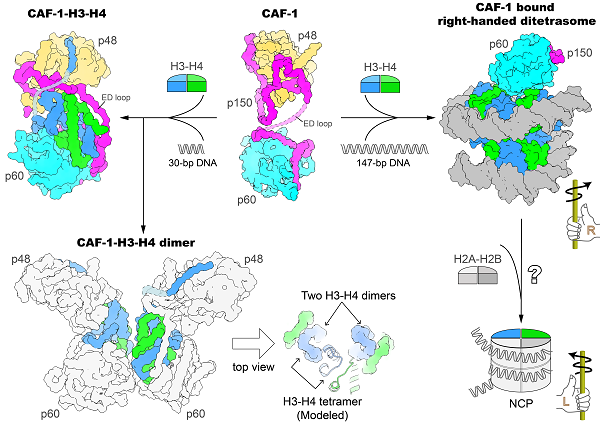
图:人源CAF-1结合组蛋白H3-H4并介导核小体组装的结构基础
研究人员首先通过CAF-1复合物不同片段组合的大量结晶条件筛选,解析了人源CAF-1复合物核心部分3.5 Å的晶体结构。晶体结构显示CAF-1三个蛋白亚基按1:1:1的方式结合,p150大亚基像一根柔软的绳子,两端分别缠绕住球状的p60亚基和p48小亚基。p150的ED-loop处于无序状态,CAF-1这种灵活的架构赋予了它结合组蛋白的可塑性,方便进行组蛋白的装配。体外生化实验证实CAF-1核心部分仍具有较强的结合组蛋白和组装核小体能力,但仍然缺乏对其结合组蛋白与组装核小体分子机理的直观认识。接着研究人员通过长期的摸索与优化,发现在CAF-1-H3-H4样品中加入30-bp的DNA片段可极大地改善样品性质,并成功地解析了CAF-1-H3-H4五元复合物3.5 Å的冷冻电镜结构,该结构清楚地显示了一个CAF-1复合物结合一个H3-H4异源二聚体。CAF-1大亚基p150的ED-loop此时变得有序,像一根安全带将组蛋白H3-H4牢牢绑住。对ED-loop突变体的体外生化和体内DNA复制偶联核小体组装实验数据分析表明,ED-loop的碳端对于DNA复制偶联的核小体组装至关重要。CAF-1三亚基协同作用结合组蛋白H3-H4的模式非常独特,p60挡住了H3-H4二聚体进一步形成四聚体的位置,解释了CAF-1无法直接结合H3-H4四聚体的原因。另外,30-bp DNA的加入促使部分CAF-1-H3-H4复合物形成二聚体,研究者也成功地捕获到了该二聚复合体4.6 Å的电镜结构,发现该复合体中两个H3-H4二聚体的排列方式与H3-H4四聚体中的排列类似但不完全一样,说明DNA与CAF-1共同参与组蛋白H3-H4四聚体的形成。当加入147-bp DNA进行组装时,研究人员意外地获得了CAF-1结合右手螺旋Di-tetrasome这一核小体组装中间态的3.8 Å的电镜结构。体外单分子磁镊实验也证实CAF-1在生理盐条件下可诱导右手螺旋核小体组装中间态的形成。这种与左手螺旋的成熟核小体NCP截然相反的手性,提示在核小体组装过程中可能存在保护性的中间步骤。
总之,该研究厘清了CAF-1结合何种组蛋白H3-H4聚合状态的长期争议,捕获到CAF-1促进组蛋白H3-H4二聚体四聚化的中间态构象,并首次发现了CAF-1诱导右手螺旋核小体组装中间态的形成,提示了手性可能是调控核小体装配一个重要手段,刷新了人们对核小体装配过程的认知。
中国科学院生物物理研究所许瑞明研究员,李国红、朱冰和刘超培研究员为本文的共同通讯作者。刘超培研究员,郁珍瑜和熊俊副研究员、胡杰、宋傲群和丁栋博为本文的共同第一作者。哥伦比亚大学张志国教授、南开大学杨娜教授、安徽大学王明珠教授、生物物理所李伟和章新政研究员对该论文提供了重要指导。该研究获得了科技部重点研发计划、国家自然科学基金、中国科学院战略性先导科技专项、中国科学院青促会和腾讯新基石等项目的资助,上海同步辐射光源、生物物理所生物成像中心和蛋白质科学平台提供了重要的技术支持。
文章链接:https://www.science.org/doi/epdf/10.1126/science.add8673
(供稿:许瑞明研究组)
 附件下载:
附件下载: