生物遗传信息的精确传递对生命的繁衍和进化至关重要,高等真核生物DNA复制需要确保亲代DNA包含的遗传信息准确传递给子代,复制起始位点的正确选择是其中的重要环节。最新研究表明,在多细胞动物中含组蛋白变体H2A.Z的核小体通过结合组蛋白赖氨酸甲基转移酶SUV420H1促进组蛋白H4第20位赖氨酸的二甲基化(H4K20me2)的富集,并招募起始识别复合物完成复制起始位点的选择1。
2023年8月2日,中国科学院生物物理研究所周政课题组联合本所李国红、朱平课题组,以及深圳湾实验室龙海珍课题组,在《Molecular Cell》在线发表了题为Structural insight into H4K20 methylation on H2A.Z-nucleosome by SUV420H1的研究论文,报道了人源SUV420H1结合H2A.Z核小体的高分辨率电镜结构,揭示了SUV420H1优先识别H2A.Z核小体并催化H4K20me2的分子机理(图1)。
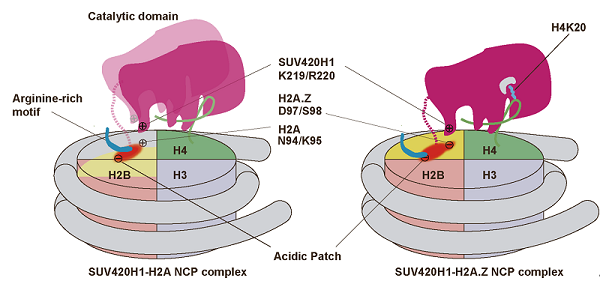
图1:SUV420H1与H2A.Z/H2A核小体和复合物结构示意图
该研究通过化学合成的方法在催化位点引入正亮氨酸突变,提高了SUV420H1-H2A.Z核小体复合物的稳定性,并解析了3.2 Å的近原子分辨率的冷冻电镜结构。结构显示SUV420H1与核小体中的H4 N端、DNA、以及酸性区域等进行结合。其中, H4 (1-12)与核小体表面的H3-H4区域作用,而H4 (13-18)与SUV420H1的缝隙结合,这使得H4延伸方向发生掉转,H4 (19-24)伸入SUV420H1活性中心。H4 N端形成的这种套索状结构将H4K20准确定位到SUV420H1催化中心的疏水通道,使甲基转移反应完成(图1. B),破坏该结构或者其中的任一的相互作用都将影响SUV420H1的甲基化功能。结构显示SUV420H1 KR loop与H2A.Z特异残基D97/S98毗邻(对应的H2A残基为N94/K95),KR loop突变降低SUV420H1对H2A.Z核小体,而非H2A核小体的甲基化活性。体内研究表明KR loop突变导致细胞H4K20me2水平下降, DNA复制起始减缓,以及细胞生长缺陷。早期研究中发现H2A.Z D97/S98可以决定SUV420H1对H2A.Z核小体的优先识别,与本研究的结果一致。
该研究揭示了SUV420H1优先识别H2A.Z核小体并催化产生H4K20me2的结构基础,阐述了SUV420H1通过H2A.Z调控DNA复制起始的分子机理,为药物靶向设计与疾病治疗提供了重要基础2。H2A.Z作为关键的组蛋白变体几乎参与所有以染色质为模板的生物学过程,周政课题组致力于研究组蛋白伴侣或染色质重塑复合物对H2A.Z变体进行优先识别的分子机制,揭示了H2A.Z在核小体组装及去组装过程的选择性识别模式及其对应的生物学功能3-8。然而,H2A.Z核小体作为整体被优先识别的分子基础,迄今尚未见报道。本研究首次阐明了H2A.Z核小体的优先识别机理,深化了对组蛋白变体结构和功能的了解。

封面图:研究揭示了甲基转移酶SUV420H1优先识别H2A.Z核小体并进行H4K20me2修饰的机制。SUV420H1被描绘成一个精灵,精灵用魔棒在含有变体组蛋白的核小体上点亮标记,该研究阐明了H2A.Z和SUV420H1在DNA复制起始中的作用。
中国科学院生物物理研究所周政、李国红、朱平研究员及深圳湾实验室龙海珍研究员为共同通讯作者,生物物理研究所助理研究员黄莉,博士后王有望和龙海珍研究员为本文的共同第一作者。该研究获得国家自然科学基金委、北京市科学技术委员会、中国科学院项目等项目资助,生物物理所蛋白质科学平台、生物成像中心提供了重要支撑和保障。
文章链接:
https://doi.org/10.1016/j.molcel.2023.07.001
1. Long, H., Zhang, L., Lv, M., Wen, Z., Zhang, W., Chen, X., Zhang, P., Li, T., Chang, L., Jin, C., et al. (2020). H2A.Z facilitates licensing and activation of early replication origins. Nature 577, 576-581. 10.1038/s41586-019-1877-9.
2. Paulsen, B., Velasco, S., Kedaigle, A.J., Pigoni, M., Quadrato, G., Deo, A.J., Adiconis, X., Uzquiano, A., Sartore, R., Yang, S.M., et al. (2022). Autism genes converge on asynchronous development of shared neuron classes. Nature 602, 268-273. 10.1038/s41586-021-04358-6
3. Huang, Y., Dai, Y., and Zhou, Z. (2020). Mechanistic and structural insights into histone H2A-H2B chaperone in chromatin regulation. Biochem. J. 477, 3367-3386. 10.1042/BCJ20190852.
4. Dai L, Xiao X, Pan L, Shi L, Xu N, Zhang Z, Feng X, Ma L, Dou S, Wang P, Zhu B, Li W, Zhou Z. (2021) Recognition of the inherently unstable H2A nucleosome by Swc2 is a major determinant for unidirectional H2A.Z exchange. Cell Rep. 35(8):109183.
5. Huang Y, Sun L, Pierrakeas L, Dai L, Pan L, Luk E, Zhou Z. (2020) Role of a DEF/Y motif in histone H2A-H2B recognition and nucleosome editing. Proc Natl Acad Sci USA. 117(7): 3543-3550.
6. Wang Y, Liu S, Sun L, Xu N, Shan S, Wu F, Liang X, Huang Y, Luk E, Wu, C, Zhou Z. (2019) Structural insights into histone chaperone Chz1-mediated H2A.Z recognition and histone replacement. PLoS Biol. 17(5): e3000277.
7. Liang X, Shan S, Pan L, Zhao J,Ranjan A, Wang F, Zhang Z, Huang Y, Feng H, Wei D, Huang L, Liu X, Zhong Q, Lou J, Li G, Wu C, Zhou Z. (2016) Structural basis of H2A.Z recognition by SRCAP chromatin-remodeling subunit YL1. Nat Struct Mol Biol. 23(4):317-325.
8. Mao Z, Pan L, Wang W, Sun J, Shan S, Dong Q, Liang X, Dai L, Ding X, Chen S, Zhang Z, Zhu B, Zhou Z. (2014) Anp32e, a higher eukaryotic histone chaperone directs preferential recognition for H2A.Z. Cell Res. 24(4):389-399.
(供稿:周政研究组)
 附件下载:
附件下载: