2023年6月26日,中国科学院生物物理研究所王艳丽研究团队与英国塞恩斯伯里实验室(The Sainsbury Laboratory)马文勃研究团队合作在《Cell》杂志发表了题为" Pathogen protein modularity enables elaborate mimicry of a host phosphatase"的文章,首次发现在疫霉属病原微生物中,普遍存在一类WY1-(LWY)n效应子蛋白, 通过保守的PP2A interacting module 挟持宿主细胞中的PP2A核心酶。
在病原微生物感染植物过程中,为了有效侵染宿主,病原微生物会向宿主细胞中分泌一大类蛋白分子,即效应子(effectors)。效应子通过操纵宿主细胞的免疫相关分子,进而干扰植物细胞的免疫防御过程,从而使得病原菌更容易侵染植物。为了进一步探究效应子与特定宿主分子的相互作用,在本研究中,我们以来自大豆疫霉(Phytophthora sojae)的效应子PSR2为研究对象,通过免疫共沉淀检测,发现其可以挟持宿主细胞中的PP2A核心酶,并形成一种非传统型的全酶形式。该全酶干扰了宿主细胞的某些代谢通路,使得病原微生物更易侵染植物。
此外,我们还利用晶体学手段,解析了2.3埃PSR2-PDF1二元复合物晶体结构(图1),发现PSR2的LWY2-LWY3 (命名为PP2A interacting module) 形成的凹槽形结构,与内源B亚基竞争结合相同的位点,结合位点都位于A亚基的N端。在竞争结合过程中,PSR2可以有效的竞争掉内源全酶中的B亚基。此外,通过序列比对以及结构叠合分析,我们发现PP2A interacting module这个区域的氨基酸在已鉴定的WY1-(LWY)n效应子蛋白中,具有较高的结构,序列保守性。我们将筛选出保守性较高的15个效应子蛋白,通过体内生化实验一一鉴定。发现了其中12个也具备挟持宿主细胞中的PP2A核心酶的功能。为了进一步验证该结论,我们选出了其中一种蛋白PITG_15142,并拿到了该蛋白的晶体结构。通过结构分析以及体外生化实验证实了PP2A interacting module 的保守性。
总之,本论文揭示了在疫霉属中,普遍存在一类WY1-(LWY)n效应子蛋白, 通过保守的PP2A interacting module挟持宿主细胞中的PP2A核心酶,并形成一种非传统型的全酶形式,干扰宿主细胞的某些免疫防御过程,使得病原微生物更易侵染植物(图2)。疫霉的感染是全球植物健康和粮食安全的主要威胁。本论文发现可以为植物病原菌防御提供重要理论支持。
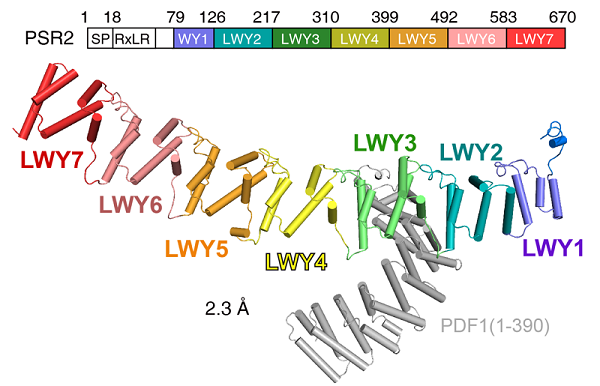
图1:PDF1(1-390)-PSR2(59-670)二元晶体复合物结构
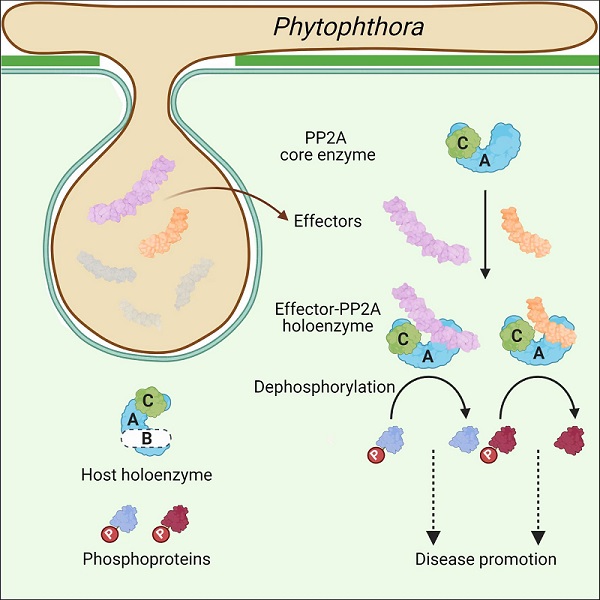
图2:效应蛋白挟持宿主PP2A核心酶示意图
英国塞恩斯伯里实验室博士后李辉以及中国科学院生物物理研究所博士生王金龙为本文的共同第一作者。英国塞恩斯伯里实验室马文勃以及生物物理研究所王艳丽为共同通讯作者。本研究得到国家自然科学基金委项目、中国科学院战略性先导科技专项(B类)、中国科学院前沿科学重点研究项目的经费支持。
文章链接:
https://www.sciencedirect.com/science/article/pii/S0092867423006402
(供稿:王艳丽研究组)
 附件下载:
附件下载: