乳腺癌免疫抑制微环境的形成和维持离不开肿瘤细胞自身分泌的免疫抑制性细胞因子,如TGF-β1、IL-10、IL-17等。临床数据显示,乳腺癌患者肿瘤组织TGF-β1表达与患者肿瘤的恶化以及生存期缩短成正相关。随着研究的深入,发现肿瘤细胞分泌的胞外囊泡携带大量的TGF-β1,且携带TGF-β1的胞外囊泡(Extracellular Vesicle-associated TGF-β, TGF-β1EV)一旦分泌,可被靶细胞吞噬入胞,并快速激活TGF-β1下游信号通路。作为乳腺癌微环境中重要的免疫抑制因子,TGF-β1信号传导可高效诱导naive CD4+ T细胞向调节性T细胞(Treg)分化,导致肿瘤内免疫抑制性微环境的建立,促进肿瘤发展。
2023年4月7日,中国科学院生物物理研究所梁伟课题组与中国医学科学院肿瘤医院合作在Breast Cancer Research杂志在线发表了题为"PKC-ζ mediated reduction of the extracellular vesicles-associated TGF-β1 overcomes radiotherapy resistance in breast cancer"的研究论文。该论文发现:乳腺肿瘤经放射治疗后,其肿瘤部位的TGF-β1水平显著增加,诱导肿瘤微环境CD4+ T细胞向Treg细胞的分化,而Naringenin以不同于TGF-β1抗体的作用机制,有效地干预这一过程,降低乳腺癌的放疗抵抗。
放射治疗(Radiotherapy,RT)是目前乳腺癌的重要治疗手段,但却无法有效控制肿瘤的复发和转移。乳腺肿瘤细胞作为肿瘤微环境(TME)中最主要的组成部分,在接受放疗后可释放大量胞外囊泡,这些囊泡很容易被未经辐照细胞摄取,导致肿瘤的复发和放疗抵抗。研究发现,RT治疗可引起患者肿瘤部位TGF-β1水平显著增加,然而,患者血液中的TGF-β1含量却并无明显变化,这提示我们,放疗诱导肿瘤细胞分泌的TGF-β1主要以结合形式的分子存在,如存在于胞外囊泡上(TGF-β1EV),因此不易从肿瘤部位扩散到血液,TGF-β1EV极有可能是乳腺癌TME免疫抑制微环境形成的主要介质。
基于梁伟课题组的前期研究,小分子黄酮类化合物柚皮素(Naringenin,缩写Nar)能调节DC细胞脂质过氧化水平,抑制乳腺肿瘤细胞PKC的活化及TGF-β1分泌,从而平衡病理状态失常的机体。本研究中,梁伟组与医科院肿瘤医院赵自然课题组的合作研究发现,来自临床非小细胞肺癌患者的肿瘤细胞,其分泌的TGF-β1有72%以TGF-β1EV的形式存在。同样地,小鼠的乳腺肿瘤细胞分泌的TGF-β1有高达67~82%存在于胞外囊泡上。在乳腺癌荷瘤小鼠接受放疗后,肿瘤微环境中的TGF-β1EV的水平及Treg细胞的比例显著增加。放疗诱导肿瘤细胞活性氧的水平急剧增加,引起Zn离子的释放,进一步诱导PKC的磷酸化水平增加。本研究通过对比放疗后乳腺肿瘤细胞中PKC不同亚型的差异表达,筛选出对放疗敏感的PKC-ζ亚型在调控放疗抵抗中起重要作用。更为重要的是,我们发现柚皮素而不是1D11显著提高了放射治疗的疗效,且副作用较低。与TGF-β1的中和抗体1D11的作用机制完全不同,柚皮素降低乳腺癌放疗抵抗的分子机制是通过下调辐射激活的放射激活的超氧化物-锌离子-PKC-ζ-TGF-β1EV通路(图1)。本研究揭示了Naringenin调控乳腺癌放疗抵抗的分子机制,为开发新型高效的TGF-β1靶向抑制剂及优化肿瘤放疗的联合治疗方案提供依据。
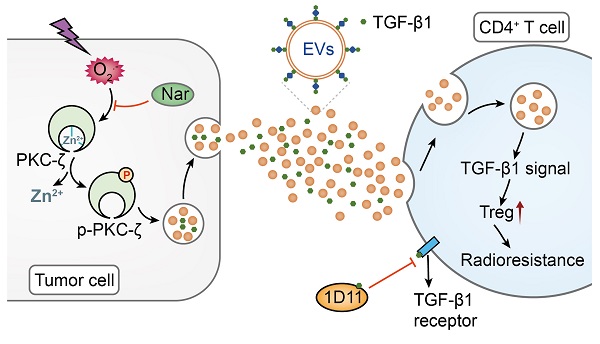
图1:乳腺癌放疗微环境TGF-β1EV的分子调控机制:放射治疗激活肿瘤细胞的超氧化物-锌离子-PKC-ζ-TGF-β1EV通路,携带TGF-β1的囊泡胞外释放后被CD4+ T靶细胞内吞,激活TGF-β1胞内信号通路,分化为Treg,引起肿瘤的放疗抵抗。Nar通过抑制肿瘤细胞活性氧水平,降低PKC-ζ的磷酸化化水平,抑制携带TGF-β1的囊泡的分泌,达到降低放疗抵抗的目的。而1D11与游离TGF-β1结合,不能阻断TGF-β1EV的信号通路,无法发挥其与放疗联合的优势。
中科院生物物理研究所梁伟研究员,张发云副研究员和中国医学科学院肿瘤医院胸外科赵自然主治医师为本文的共同通讯作者,该研究得到国家自然科学基金项目的支持。
文章链接: https://doi.org/10.1186/s13058-023-01641-4
(供稿:梁伟研究组)
 附件下载:
附件下载: