乙型肝炎病毒(HBV)感染是世界范围内的一个重大公共卫生问题,全球约有2.57亿慢性HBV感染者。全球每年约有88.7万人死于HBV感染相关疾病,肝硬化和原发性肝细胞癌(HCC)患者中由HBV所致者分别为30%和45%。我国肝硬化和HCC患者中,由HBV所致者分别为77%和84%。目前我国一般人群HBsAg流行率为5%~6%,慢性HBV感染者约7000万例,其中慢性乙型肝炎(CHB)患者约为2000万~3000万例。
预防性乙肝疫苗具有良好的保护作用,接种预防性乙肝疫苗大大降低了HBV的感染率,但不能在CHB患者中产生中和性抗体清除病毒。目前批准上市用于治疗CHB的药物有I型干扰素(IFNs)和5种核苷(酸)类似物(NAs),可抑制HBV的复制,但均很难实现"表面抗原(HBsAg)阴转伴或不伴表面抗体(抗-HBs)出现、HBV DNA检测不到等"的CHB功能性治愈。IFN全身给药(皮下或肌肉注射)应答率低,副作用大,如何克服 IFN全身给药的不足,实现CHB功能性治愈是一个极具挑战性的难题。
2022年10月31日,中科院生物物理所彭华研究员和清华大学医学院傅阳心教授在《Gut》杂志上在线发表题为"Engineered anti-PDL1 with IFNα targets both immunoinhibitory and activating signals in the liver to break HBV immune tolerance"的论文。研究人员开发出一种anti-PDL1抗体与IFNα的融合蛋白(anti-PDL1-IFNα),利用anti-PDL1将IFNα靶向到肝脏,以实现在局部发挥IFNα抗病毒和调节免疫的作用,提高IFNα的有效性和降低副作用。
Anti-PDL1-IFNα融合蛋白通过三个方面作用打破HBV诱导的免疫耐受:(1)将IFNα靶向到肝脏抑制HBV复制,降低病毒载量,发挥IFNα直接抗病毒作用;(2)将IFNα靶向到肝脏中树突状细胞(DC),上调DC细胞共刺激分子CD80、CD86和MHCI以及其抗原提呈能力进而促进HBV特异性T细胞的功能;(3)发挥免疫检查点阻断作用,克服PDL1介导的免疫抑制,实现免疫调节作用。Anti-PDL1-IFNα融合蛋白的治疗效果显著高于IFNα或anti-PDL1单药治疗以及IFNα与anti-PDL1的联合用药。研究人员发现融合蛋白中IFNα诱导肝脏中PDL1上调有利于anti-PDL1-IFNα更有效的肝脏靶向性,实现anti-PDL1-IFNα融合蛋白中anti-PDL1与IFNα的协同抗病毒作用。研究证明:利用anti-PDL1-IFNα融合蛋白的免疫调节作用及其抗病毒作用降低肝脏和外周血中HBsAg和HBV-DNA水平,为实现打破免疫耐受提供"窗口期";联合疫苗主动免疫,能够诱导宿主HBV特异性T细胞和B细胞反应,达到慢性乙型肝炎的功能性治愈。
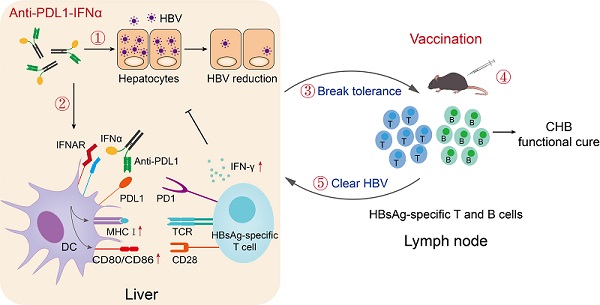
图. Anti-PDL1-IFNα融合蛋白联合乙肝疫苗促进实现CHB功能性治愈
中国科学院生物物理研究所助理研究员孟朝阳是本论文的第一作者;中国科学院生物物理研究所彭华研究员和清华大学医学院傅阳心教授是本论文的共同通讯作者,并得到中国人民解放军总医院第五医学中心王福生院士团队的大力支持。该研究得到国家科技重大专项的资助。生物物理所实验动物平台和公共技术平台为该研究提供了重要的支撑和帮助。
文章链接:https://gut.bmj.com/content/early/2022/10/31/gutjnl-2022-327059
(供稿:彭华研究组)
 附件下载:
附件下载: