DNA承载着细胞的遗传信息,其稳定传递和精确复制对于生命体的生存至关重要。病毒基因组的整合、DNA错配或环境物理化学因子的影响都会造成DNA损伤的发生并导致基因组不稳定,进而诱发癌症等疾病。因此细胞进化出了一套完整的DNA损伤应答(DDR)体系来应对这些挑战。另一方面,由于许多病毒侵染宿主细胞后会引起宿主DDR,病毒发展出相关策略来对抗宿主DDR,或者利用宿主DDR完成其生命周期,与宿主开展"博弈"。
EB病毒(Epstein-Barr virus)是一种具有双链DNA基因组的γ疱疹病毒,EB病毒感染了世界上约90%的人口并与多种恶性肿瘤相关。研究发现EB病毒的被膜蛋白BKRF4与人体组蛋白H2A-H2B二聚体和H3-H4四聚体相互作用,BKRF4破坏损伤修复因子RNF168的招募,干扰宿主DDR,BKRF4的高表达与病毒致癌性相关。因此,揭示BKRF4识别并调控染色质结构的机制,对于了解EB病毒与宿主之间的"博弈机制"非常重要。
2022年9月6日,《Proceedings of the National Academy of Sciences of the United States of America》在线发表了中国科学院生物物理研究所周政课题组和北京大学徐冬一课题组合作完成的研究论文"Epstein-Barr virus protein BKRF4 restricts nucleosome assembly to suppress host antiviral responses"。该研究通过结构生物学、生物化学和细胞生物学等研究手段揭示了EB病毒蛋白BKRF4调控宿主核小体组装并抑制宿主DDR的分子机制。
研究人员首先解析了BKRF4组蛋白结合元件(HBD)与人H2A-H2B二聚体复合物的高精度晶体结构,同时利用核磁共振(NMR)、等温量热滴定(ITC) 、pull-down等方法证明BKRF4-HBD通过"三元结合"模型与H2A-H2B二聚体相互作用。在此基础上,研究人员通过单分子磁镊、凝胶迁移等实验证明, BKRF4-HBD特异识别并结合到半开放的核小体、而非完全折叠的核小体表面,并促进核小体解聚,抑制RNF168在染色质上的富集,调控宿主DDR。通过激光诱导DNA辐射损伤、免疫荧光等实验方法,研究人员进一步证明在DNA损伤发生后,BKRF4可以被快速招募到细胞发生DNA损伤位点,破坏BKRF4与H2A-H2B二聚体的相互作用会严重影响BKRF4在DSB位点的招募,使其失去抑制DDR信号的能力。
综上,本研究揭示了EB病毒蛋白BKRF4在DDR过程中通过结合宿主染色质,调控染色质组装来抑制宿主DDR信号传导的分子机制。BKRF4-HBD的"三元结合"模型赋予了BKRF4-HBD与半开放核小体相互作用的能力。与前人报道的KSHV、PFV和HCMV病毒蛋白通过识别核小体酸性区域结合到核小体表面的作用模型不同,本研究探明了一种新的核小体结合模式,揭示了BKRF4识别DNA损伤、破坏染色质组装、调控宿主DDR的作用机制。
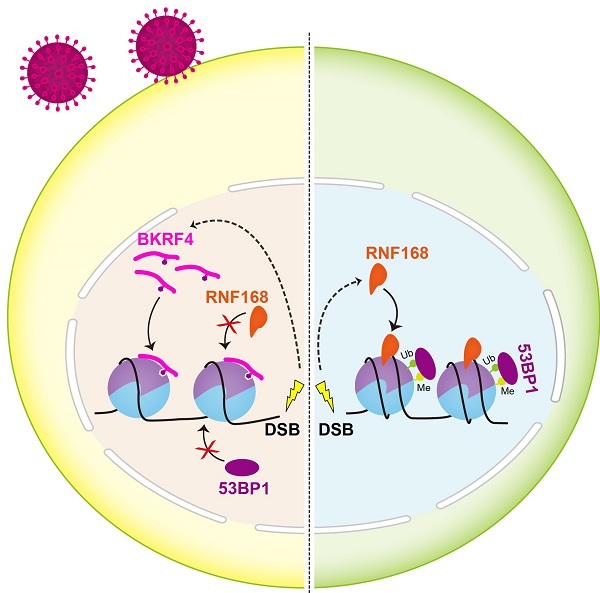
图 BRKF4调控宿主核小体组装并抑制宿主DNA损伤应答的模型
生物物理所周政研究员、北京大学徐冬一研究员、生物物理所单珊副研究员为本文的共同通讯作者。周政课题组博士生谌姣为本文第一作者。徐冬一课题组博士研究生卢祖儿、生物物理所副研究员宫维斌、工程师冯晓利、物理所研究员李伟、博士后肖雪等也参与了该项研究。该研究获得国家重点研发计划、国家自然科学基金、中国科学院战略性先导科技专项(B类)、中国科学院青年创新促进会资助。上海同步辐射光源(SSRF)及生物物理所实验平台为该研究提供了重要的技术支持。
文章链接:https://www.pnas.org/doi/10.1073/pnas.2203782119
(供稿:周政研究组)
 附件下载:
附件下载: