物质在细胞核和细胞质的正常转运对于细胞正常生理功能的维持是必须的,而在病毒感染时,其对于细胞抗病毒状态的建立同样至关重要。病毒在与宿主长期的博弈过程中,进化出了多种手段来逃逸宿主的抗病毒反应;其中,干扰核质转运过程、阻止细胞建立合适的抗病毒环境,是病毒重要的策略之一。
中国科学院生物物理研究所邓红雨课题组和高璞课题组曾在2020年合作解析了疱疹病毒MHV-68 ORF10蛋白与宿主mRNA转运复合物Rae1-Nup98的三元复合物结构,并揭示了ORF10选择性抑制mRNA出核转运的分子机理(PNAS, 2020)。在该工作中,研究者意外发现,完全不同的病毒蛋白(疱疹病毒ORF10蛋白和水泡性口炎病毒基质蛋白M)都可以结合到Rae1-Nup98的RNA结合口袋,提示该位点是病毒拮抗细胞抗病毒功能的重要靶点。
Sarbecovirus(包含SARS-CoV-2、 SARS-CoV等病毒)不仅在S蛋白上发生大量突变,突破中和抗体、疫苗的保护作用,且其编码的多个辅助蛋白也具有抑制宿主天然免疫的能力。研究发现,SARS-CoV-2辅助蛋白ORF6与Rae1-Nup98互作,并抑制宿主天然免疫反应。然而,ORF6与Rae1-Nup98复合物互作的结构基础以及ORF6发挥抑制功能的详细分子机制,目前尚不清楚。为此,邓红雨课题组与中国医学科学院病原所崔胜课题组合作开展研究,于8月15日在《Nature Communications》杂志在线发表了题为"Structural Basis for Sarbecovirus ORF6 Mediated Blockage of Nucleocytoplasmic Transport"的论文。
研究人员分别解析了SARS-CoV-2和SARS-CoV 的辅助蛋白ORF6 C-末端片段(CTT)与细胞核孔复合物组分Rae1-Nup98形成的2个复合物晶体结构,进而利用生化、生物物理和细胞功能实验等多种技术揭示了ORF6 阻碍蛋白、mRNA等物质的核孔双向运输以及抑制细胞抗病毒免疫应答的分子机制。研究人员将解析的Sarbecovirus ORF6 CTT- Rae1-Nup98复合物的结构(2.85 Å 和2.39 Å)与已知结构数据库进行比对分析,发现Sarbecovirus ORF6与水疱性口炎病毒M蛋白和疱疹病毒ORF10相似,这些病毒蛋白的靶点均位于Rae1-Nup98复合物表面的mRNA结合口袋。利用ITC、EMSA等技术,进一步证明了ORF6 CTT与mRNA竞争结合Rae1-Nup98的mRNA结合口袋,从而解释了ORF6抑制mRNA核-质运输的原理。
接下来,研究人员对ORF6进行系统突变,并通过Co-IP实验、GFP报告基因的表达测定、GFP-mRNA的核质分布测定、干扰素报告系统以及免疫荧光等实验,明确了ORF6与Rae1-Nup98互作的关键氨基酸位点,揭示了ORF6 CTT与 Rae1-Nup98的亲和力与ORF6抑制mRNA出核以及STAT分子入核的功能正相关,同时提出了ORF6 CTT作为一种新型免疫调节剂的潜在应用前景。该工作也进一步证明了Rae1-Nup98的mRNA结合口袋可以被不同的病毒蛋白所劫持,同时也为设计新的抗病毒方案提供了思路。
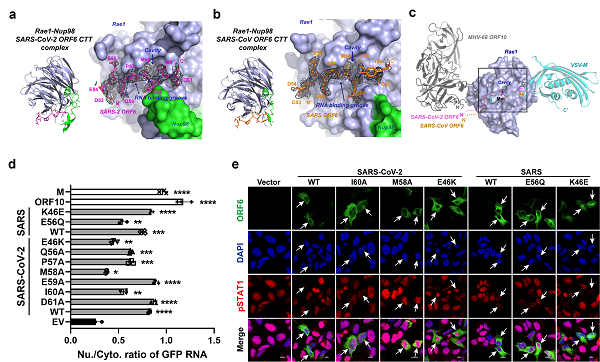
SARS-CoV-2/SARS-CoV ORF6与Rae1-Nup98的复合物晶体结构及其对核质转运的抑制作用
崔胜和邓红雨研究员为论文的共同通讯作者,崔胜课题组副研究员高小攀,邓红雨课题组助理研究员田华彬以及崔胜课题组博士后朱凯翔为论文的共同第一作者。该研究获得中国医学科学院医学科技创新工程、科技部国家重点研发计划、国家自然科学基金、中科院战略性科技先导专项(B类)、北京市自然科学基金等的资助。
(供稿:邓红雨研究组)
 附件下载:
附件下载: