在中枢神经系统中,谷氨酸(Glutamate)是含量最高、分布最广的兴奋性神经递质,通过激活突触后膜谷氨酸受体,参与大脑的学习和记忆等功能。突触间隙中兴奋性谷氨酸水平必须受到严格调节,以避免谷氨酸受体过度刺激导致的谷氨酸兴奋性毒性。表达于星形胶质细胞质膜上的兴奋性谷氨酸转运蛋白2(hEAAT2)通过利用转运离子的跨膜电化学梯度和膜电位为驱动力,将突触间隙中约90%谷氨酸转运到细胞中进行清除。hEAAT2属于SLC1A家族蛋白,具有谷氨酸转运和介导阴离子电导的双重功能。该蛋白功能失调或障碍时,可导致癫痫、帕金森病、发作性共济失调和肌萎缩侧索硬化症等多种神经系统疾病,是重要的药物治疗靶标。然而,目前还没有以此类蛋白(EAATs)为治疗靶标的药品上市。因此,对hEAAT2蛋白配体结合模式的阐释,将对治疗hEAAT2相关神经系统疾病具有极其重要意义。
2022年6月9日,中国科学院生物物理研究所赵岩课题组和东北农业大学生命科学学院姜巨全课题组,以及北京大学药学院黄卓课题组在《Nature Communications》上合作发表题为"Structural basis of ligand binding modes of human EAAT2"的研究论文。该研究报道了两个分辨率均为3.4 Å的hEAAT2结合天然底物Glutamate(hEAAT2Glu)或抑制剂WAY-213613(hEAAT2W)的复合物结构(图1),阐明了hEAAT2配体结合的结构基础。结合电生理技术,验证了氨基酸残基S441HP2对Glutamate和抑制剂结合具有重要作用;同时鉴定出I464-L467-V468残基簇是抑制剂WAY-213613高选择性结合hEAAT2的结构基础。
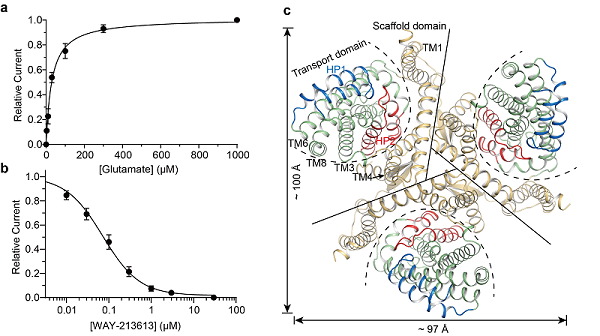
图1:hEAAT2蛋白功能表征和整体结构。(a)野生型hEAAT2阴离子电流的Glutamate浓度依赖的激活曲线;(b)野生型hEAAT2阴离子电流的WAY-213613浓度依赖的抑制曲线;(c)hEAAT2三聚体细胞质侧视图。
在hEAAT2Glu结构中,Glutamate与其周围广泛而保守残基参形成极性相互作用,其中包含残基D475TM8和R478TM8(图2a)。同时,蛋白HP2通过特异性残基S441HP2和S444HP2与其他结构元件形成氢键,起到维持HP2关闭进而稳定Glutamate结合的作用。电生理实验结果证明,氨基酸残基D475TM8和R478TM8突变后突变体保留通道活性,但丧失Glutamate结合能力(图2b)。令人意外地,当hEAAT2上特异的氨基酸残基S441HP2突变为同源蛋白保守的甘氨酸残基后,突变体对Glutamate亲和力比野生型提高了77倍(图2c),推测该突变破坏了残基维持HP2关闭的相互作用,从而促进Glutamate释放,加速Glutamate转运循环,致使hEAAT2偏向具有更高通道开放概率。
在hEAAT2W复合物结构中,抑制剂WAY-213613通过极性或疏水相互作用(图2d),占据谷氨酸相似的结合位点。氨基酸残基D475TM8、R478TM8和S441HP2与抑制剂形成极性或阳离子-π键相互作用稳定抑制剂结合(图2b和2d)。同时,I464-L467-V468残基簇对于WAY-213613高选择性、高亲和力结合hEAAT2十分关键。电生理实验证明,这些关键氨基酸的突变都显著的降低WAY-213613对hEAAT2的抑制作用(图2e-f)。这些结构信息清楚地阐明了hEAAT2的配体结合模式,为未来药物的设计和开发提供了结构基础。
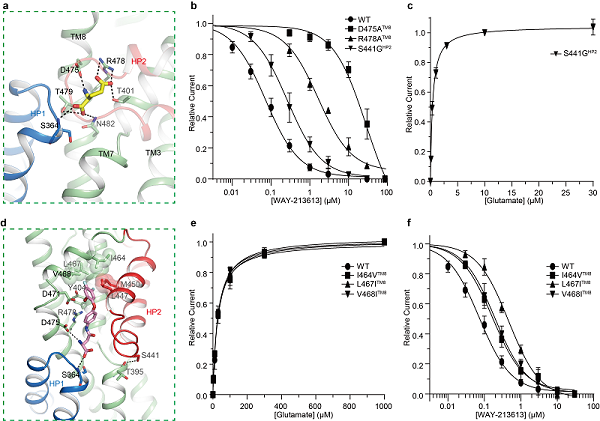
图2:hEAAT2蛋白配体结合位点及关键氨基酸残基功能验证。(a)hEAAT2Glu结构中参与Glutamate结合残基;(b)突变体D475ATM8、R478ATM8和S441GHP2阴离子电流的WAY-213613浓度依赖的抑制曲线;(c)突变体S441GHP2阴离子电流的Glutamate浓度依赖的激活曲线;(d)hEAAT2W结构中参与WAY-213613结合残基;(e)突变体(I464VTM8、L467ITM8和V468ITM8)阴离子电流的Glutamate浓度依赖的激活曲线;(f)突变体(I464VTM8、L467ITM8和V468ITM8)阴离子电流的WAY-213613浓度依赖的抑制曲线。
中国科学院生物物理研究所赵岩研究员、东北农业大学生命科学学院姜巨全教授和北京大学药学院黄卓研究员是本研究论文的通讯作者。东北农业大学与生物物理研究所联合培养博士研究生张正来、陈慧文和北京大学硕士研究生耿泽为本文的共同第一作者。生物物理研究所生物成像中心为本研究提供了设备和技术支持。本研究获得了国家脑科学与类脑智能技术项目、中国科学院战略性先导研究计划、中国国家重点研发计划项目、国家自然科学基金、中国科学院生物物理研究所生物大分子国家实验室开放课题等项目资助。
文章链接:https://www.nature.com/articles/s41467-022-31031-x
(供稿:赵岩研究组)
 附件下载:
附件下载: