光电关联成像可以将荧光显微镜对分子特异性定位以及电子显微镜观察细胞超微结构的特点结合起来,实现对目标分子的精确观测。但目前大部分的荧光探针经过电镜制样之后均丧失了荧光,这大大制约了光电关联成像的发展。自从可以应用于Epon树脂包埋的光电关联探针--mEosEM发现以来,人们又陆续发现了可以应用于Epon树脂包埋的光电关联荧光蛋白,包括mKate2、mCherry2、mWasabi、GoGFP-v0等。虽然这些荧光蛋白都可以适用于光电关联成像,但是实际应用过程中却面临着荧光信号弱、树脂自发荧光强、信背比低、难以检测低丰度蛋白等问题。
3月23日,中国科学院生物物理研究所徐涛课题组和徐平勇课题组在《Cells》杂志联合发表"Improved Fluorescent Proteins for Dual-Colour Post-Embedding CLEM"文章。该研究工作在前期mEosEM(Nature Methods,2020)的基础上发展了新一代光电关联成像光开关荧光蛋白mEosEM-E,并且根据mEosEM-E的特点,对目前的光电关联成像方法进行了改进。新的成像方法sCLEM可以大幅度提高光镜成像的信背比,从而可以为研究人员提供目标蛋白更加准确可靠的定位信息。同时该研究工作还对目前的红色荧光蛋白进行了筛选,发现mScarlet-H在经过电镜制样之后表现出了优良的发光特性,可以适用在光电关联成像之中,并且利用mEosEM-E以及mScarlet-H成功实现了双色光电关联成像,为细胞生物学研究提供了新的方法。
该研究工作以mEosEM为模板,通过定点饱和突变的方法得到了新一代荧光蛋白mEosEM-E。mEosEM-E具备光开关性质,可以在405纳米激光照射下转换为"亮状态",在488纳米激光照射下转换为"暗状态"。同时mEosEM-E继承了mEosEM抵抗电镜制样的特点,在经过电镜制样和Epon包埋之后依然能够在切片之上看到荧光信号并且保持光开关性质。为了能够进一步提高光学成像的信背比,解决树脂自发荧光对荧光信号的影响,研究者根据mEosEM-E的光开关性质,开发了图像相减的策略,通过对mEosEM-E处于两种状态的图像做减法,可以很大程度上去除树脂的自发背景荧光,整体信背比相比较于"暗状态"提高了14倍,相比较于"亮状态"提高了4.6倍。同时研究人员也对红色荧光蛋白进行了筛选,将电镜制样步骤进行拆分并分步检测不同红色荧光蛋白经过处理之后剩余的荧光,最终发现mScarlet-H的光电关联成像效果最好。另外研究人员发现常规的光电关联探针的筛选方法--检测探针经过锇酸处理之后的剩余荧光,并不能反映出荧光探针在电镜切片之上的效果,因为电镜制样步骤繁多,每一步骤都可能会对荧光造成损失,前期锇酸处理步骤后的荧光效果都不能表征荧光探针最后的效果,只有树脂切片上的荧光效果才可以衡量某一荧光探针到底是否适合光电关联成像。最后,利用mEosEM-E以及mScarlet-H成功实现了核仁的双色光电关联成像。该研究工作开发了新的光电关联成像探针与方法,同时将电镜制样步骤对荧光探针的影响做了定量分析,为细胞生物学以及光电关联成像领域提供了新的方法和工具。
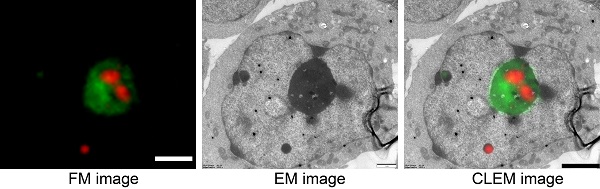
图:核仁的双色光电关联成像
中国科学院生物物理研究所徐平勇研究员、张名姝研究员和徐涛院士为本文的共同通讯作者。该研究得到科技部重点研发计划、国家自然科学基金和中科院先导专项等经费支持。
文章链接:https://www.mdpi.com/2073-4409/11/7/1077
(供稿:徐平勇研究组)
 附件下载:
附件下载: