对病原DNA的免疫识别,是宿主细胞感知病原感染的重要手段,这种免疫响应广泛存在于从低等原核生物到高等哺乳动物当中(图1)。哺乳动物细胞利用多条天然免疫通路识别病原DNA并介导免疫应答;细菌则主要依赖"R-M系统"及"CRISPR-Cas系统"来去除入侵的噬菌体DNA。

图1:宿主细胞对病原DNA的免疫识别和应答
限制修饰(Restriction-Modification;R-M)系统被称为细菌的天然免疫系统,可对宿主自身DNA进行甲基化修饰,而对未经修饰的外源DNA进行切割。作为最早被鉴定、且最为精巧复杂的R-M系统,Type I R-M系统存在多种亚基组装方式,并拥有DNA methyltransferase、DNA translocase和DNA endonuclease等酶活性。Type I R-M系统的鉴定,促成了其他类型R-M系统的发现并引发分子遗传学革命,围绕限制性酶的研究和应用也获得了1978年的诺贝尔生理医学奖。然而,虽经历了半个多世纪的广泛研究,人们对于Type I R-M 系统如何组装、如何实现多酶活转换、以及如何受到噬菌体蛋白的调控,却仍知之甚少。另外,由于该系统自身存在复杂且频繁的构象变化,获得其多种状态的高分辨率结构信息,一直是领域内极具挑战的问题。
2020年6月1日,《Nature Microbiology》杂志在线发表了高璞组与章新政组合作的研究论文"Structural insights into assembly, operation, and inhibition of a Type I restriction-modification system"。该工作以经典的Type I R-M系统EcoR124I为对象,成功制备了不同组装方式的EcoR124I系统(R2M2S1/R1M2S1/M2S1)与靶标DNA以及两种噬菌体编码蛋白(Ocr和ArdA)的多种复合物样品,解析了该系统10种不同生理构象的冷冻电镜结构,并配合大量的生化实验揭示了该系统的组装、催化和调控机制(图2)。
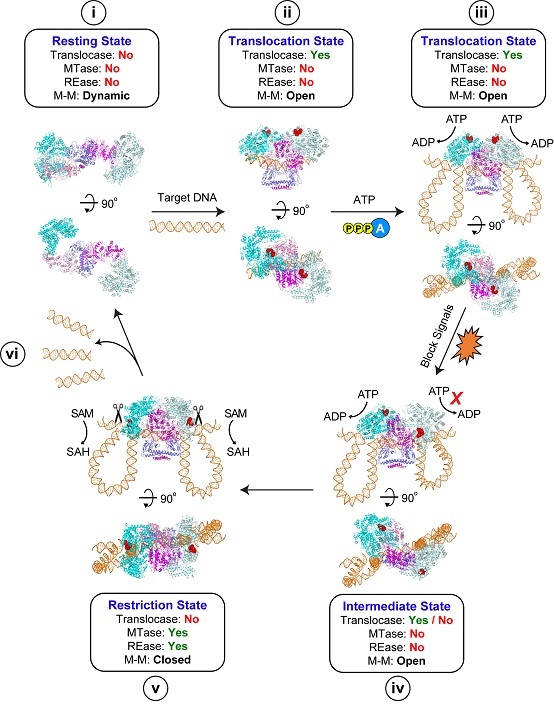
图2:Type I R-M全酶复合物的工作模型图
简单来说,这项工作有以下亮点:(1)首次明确了Type I R-M系统是通过形成不同的构象状态来精确控制不同的酶活性,而这些构象状态之前是完全未知的;(2)揭示了Type I R-M系统在不同构象状态下的组装方式,本工作中发现的多数分子间互作界面都是首次被报道;(3)阐明了噬菌体蛋白Ocr和ArdA均采取DNA mimic的方式抑制Type I R-M系统的活性,但这两种抑制蛋白并不影响该系统的构象变化;(4)本工作并不局限于解决了一个困扰数十年的结构生物学难题,更重要的是揭示了很多之前未报道的作用机制。
综上,此项研究系统性揭示了Type I R-M系统的组装、催化和调控的分子机制,有助于深入理解该系统在抵御噬菌体侵染及细菌其他生理功能中的作用,并为设计基于Type I R-M系统的生物学工具及噬菌体疗法提供了依据和思路。
高璞研究员和章新政研究员为共同通讯作者。高璞组助理研究员高艺娜和章新政组副研究员曹端方为共同第一作者。闫小雪副研究员参与了本工作的讨论和设计。冷冻电镜数据收集和样品分析等工作得到生物物理所成像中心平台的大力支持和帮助。此研究得到科技部、国家自然科学基金委和中科院的经费支持。
文章链接:https://www.nature.com/articles/s41564-020-0731-z
(供稿:高璞研究组)
 附件下载:
附件下载: