国家“杰出青年科学基金”获得者 中国科学院生物物理研究所,生物大分子重点实验室,研究组长
1997 - 2001 北京大学,学士
2001 - 2007 耶鲁大学,博士
2007 - 2013 约翰霍普金斯大学,博士后
2013 - 2015 约翰霍普金斯大学,Research Associate
2016 - 至今 中国科学院生物物理研究所,研究员
2024年 国家杰出青年科学基金
2022年 International Dictyostelium Society Junior Faculty Award
2014年 Daniel Nathans Young Investigator Award, JHU
2009年 Helen Hay Whitney Postdoctoral Fellowship
中国生物物理学会亚细胞器结构与功能分会委员
中国细胞生物学学会女科学家工作委员会委员
期刊任职
2019 – 2022 Journal of Cell Biology, Early Career Advisory Board
2022 – 至今 Front Cell Dev Biol, Review Editor
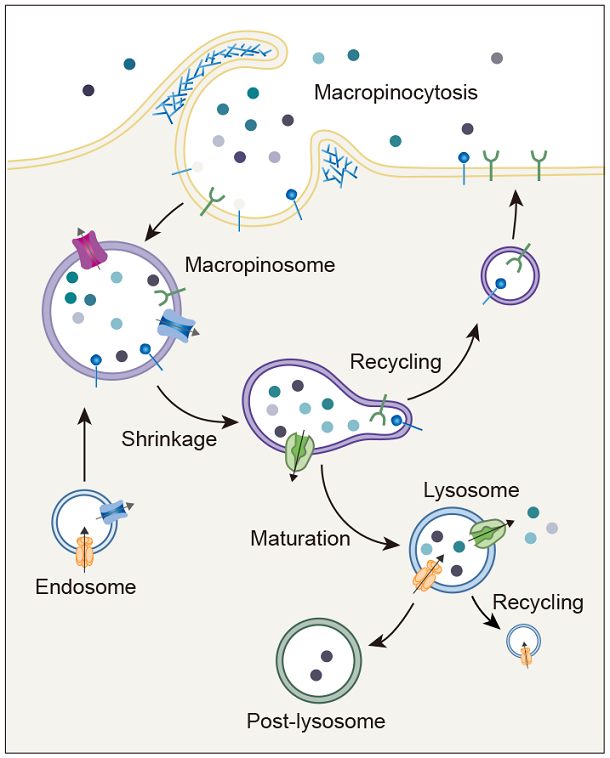
胞吞作用是细胞与环境之间物质交换和信号传递的重要途径。巨胞饮(macropinocytosis)是细胞非选择性内吞胞外液体和液相大分子的一类特殊的胞吞作用,在不同类型的细胞中发挥着多样化的功能,例如协助阿米巴细胞摄取营养物质、免疫细胞(如巨噬和树突细胞)捕获抗原、神经细胞调节突触功能。巨胞饮也与许多疾病的发生相关,例如在神经退行性疾病中介导蛋白聚集体的胞间传递、被病原体利用入侵宿主细胞,帮助癌细胞摄取蛋白质和脂肪酸等营养物质从而在肿瘤微环境中获得生长优势等。因此,巨胞饮不仅是疾病治疗的潜在靶点,也有望被发展为新型药物递送策略。
1. 巨胞饮过程的分子调控机制
巨胞饮具有独特的发生机制,在细胞骨架的驱动下质膜局部重塑,以不依赖任何物理模板和包被蛋白的方式,形成直径可达数微米的内吞囊泡-巨胞饮体(macropinosome)。巨胞饮体在经历与内吞体和溶酶体融合等步骤后成熟,降解内吞货物,并将可利用的产物运送到细胞内。我们发展了以模式细胞为基础的研究体系,通过建立基于信号分子动态变化的生化筛选方法和高内涵成像技术的正向遗传筛选系统,系统鉴定巨胞饮调控基因,阐明其在巨胞饮结构起始、形成和成熟过程中的作用机制(J Cell Biol 2021, 2023, 2024; Front Cell Dev Biol 2022; Nat Commun 2022)。
2. 巨胞饮调控网络和生理病理功能
细胞的巨胞饮水平受到营养条件、生长因子、病原体等多种因素的影响,并且需要与迁移和吞噬等细胞过程协同作用,以实现复杂的生理功能。我们的研究揭示了营养状态对巨胞饮的反馈调节和细胞应对营养胁迫调整巨胞饮水平的适应性机制,发现了甲羟戊酸代谢途径在巨胞饮介导肿瘤细胞营养摄取中的重要功能(Dev Cell 2024, J Cell Sci 2022, PNAS 2020)。我们将深入研究不同病生理条件下细胞巨胞饮活性的精确调控机制和内吞网络的适应性变化,以揭示巨胞饮调控基因的生理功能以及巨胞饮过程异常与人类疾病之间的内在联系。
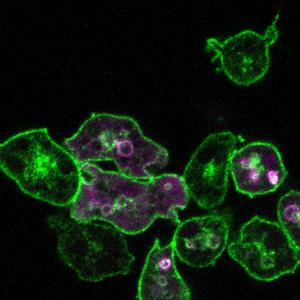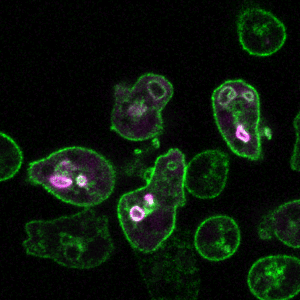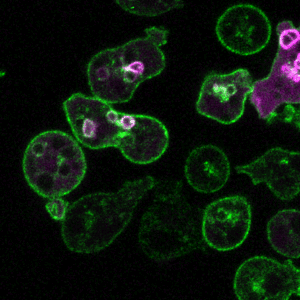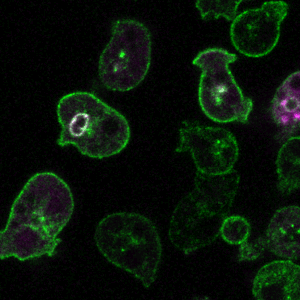
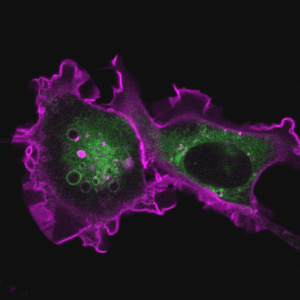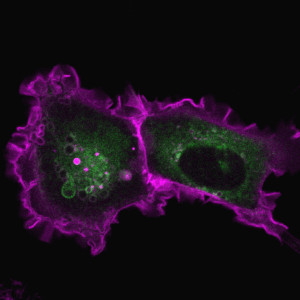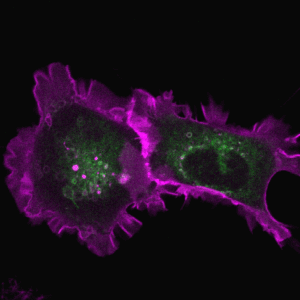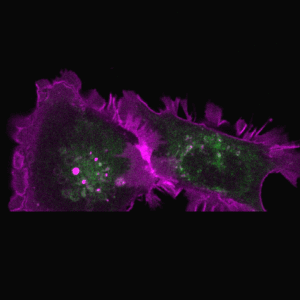
代表论著 (#corresponding)
1. Chao X*, Yang Y*, Gong W, Zou S, Tu H, Li D, Feng W, Cai H#. (2024) Leep2A and Leep2B function as a RasGAP complex to regulate macropinosome formation. Journal of Cell Biology. 223(9):e202401110.
2. Hao Y*, Yang Y*, Tu H*, Guo Z*, Chen P, Chao X, Yuan Y, Wang Z, Miao X, Zou S, Li D, Yang Y, Wu C, Li B, Li L#, Cai H#. (2024) A transcription factor complex in Dictyostelium enables adaptive changes in macropinocytosis during the growth-to-development transition. Developmental Cell. 59(5):645-660.
3. Li D*, Yang Y*, Lv C, Wang Y, Chao X, Huang J, Singh SP, Yuan Y, Zhang C, Lou J, Gao P, Huang S, Li B, Cai H#. (2023) GxcM-Fbp17/RacC-WASP signaling regulates polarized cortex assembly in migrating cells via Arp2/3. Journal of Cell Biology. 222(6):e202208151.
4. Tu H, Wang Z, Yuan Y, Miao X, Li D, Guo H, Yang Y, Cai H#. (2022) The PripA-TbcrA complex-centered Rab GAP cascade facilitates macropinosome maturation in Dictyostelium. Nature Communications. 13(1):1787.
5. Zhang Y*, Tu H*, Hao Y, Li D, Yang Y, Yuan Y, Guo Z, Li L, Wang H#, Cai H#. (2022) Oligopeptide transporter Slc15A modulates macropinocytosis in Dictyostelium by maintaining intracellular nutrient status. Journal of Cell Science. 135(7):jcs259450. Highlighted in Journal of Cell Science.
6. Li D, Sun F, Yang Y, Tu H, Cai H#. (2022) Gradients of PI(4,5)P2 and PI(3,5)P2 jointly participate in shaping the back state of Dictyostelium cells. Frontiers in Cell and Developmental Biology, 10:835185.
7. Yang Y*, Li D*, Chao X, Singh SP, Thomason P, Yan Y, Dong M, Li L, Insall RH, Cai H#. (2021) Leep1 interacts with PIP3 and the Scar/WAVE complex to regulate cell migration and macropinocytosis. Journal of Cell Biology. 220(7):e202010096. Highlighted in Journal of Cell Biology.
8. Jiao Z, Cai H#, Long Y, Sirka O, Padmanaban V, Ewarld AJ, Devreotes PN#. (2020) Statin-induced GGPP depletion blocks macropinocytosis and starves cells with oncogenic defects. PNAS. 117(8):4158-4168.
其他论著 (#corresponding)
1. Putar D, Čizmar A, Chao X, Šimić M, Šoštar M, Ćutić T, Mijanović L, Smolko A, Tu H, Cosson P, Weber I, Cai H, Filić V. (2024) IqgC is a potent regulator of macropinocytosis in the presence of NF1 and its loading to macropinosomes is dependent on RasG. Open Biol. 14(1):230372.
2. Hadwiger JA*#, Cai H*#, Aranda RG, Fatima S. (2022) An atypical MAPK regulates translocation of a GATA transcription factor in response to chemoattractant stimulation. Journal of Cell Science. 135(16):jcs260148.
3. Yang Y, Hao C, Du J, Xu L, Guo Z, Li D, Cai H, Guo H, Li L. (2022) The carboxy terminal transmembrane domain of SPL7 mediates interaction with RAN1 at the endoplasmic reticulum to regulate ethylene signalling in Arabidopsis. New Phytologist. 236(3):878-892.
4. Zhang H, Guo Z, Zhuang Y, Suo Y, Du J, Gao Z, Pan J, Li L, Wang T, Xiao L, Qin G, Jiao Y, Cai H, Li L. (2021) MicroRNA775 regulates intrinsic leaf size and reduces cell wall pectin levels by targeting a galactosyltransferase gene in Arabidopsis. Plant Cell. 33(3):581-602.
5. Gao Z, Li J, Li L, Yang Y, Li J, Fu C, Zhu D, He H, Cai H, Li L. (2021) Structural and functional analyses of Hub MicroRNAs in an integrated gene regulatory network of Arabidopsis. Genomics Proteomics Bioinformatics. S1672-0229(21)00042-5.
6. Zhuang Y, Zuo D, Tao Y, Cai H#, Li L#. (2020) Laccase3-based extracellular domain provides possible positional information for directing Casparian strip formation in Arabidopsis. PNAS. 117(27):15400-t.
7. Zhan H, Bhattacharya S, Cai H, Iglesias PA, Huang CH, Devreotes PN. (2020) An Excitable Ras/PI3K/ERK Signaling Network Controls Migration and Oncogenic Transformation in Epithelial Cells. Developmental Cell. 54(5):608-623.
8. Edwards M, Cai H, Abubaker-Sharif B, Long Y, Lampert TJ, Devreotes PN. (2018) Insight from the maximal activation of the signal transduction excitable network in Dictyostelium discoideum. PNAS. 115(16):E3722-3730.
9. Miao Y, Bhattacharya S, Edwards M, Cai H, Inoue T, Iglesias PA, Devreotes PN. (2017) Altering the threshold of an excitable signal transduction network changes cell migratory modes. Nature Cell Biology. 19(4):329-340.
10. Senoo H, Cai H, Wang Y, Sesaki H, Iijima M. (2016) The novel RacE binding protein GflB sharpens Ras activity at the leading edge of migrating cells. Molecular Biology of the Cell. 27(10):1596-1605.
11. Hoeller O*, Toettcher J*, Cai H, Sun Y, Huang CH, Freyre M, Zhao M, Devreotes PN, Weiner O. (2016) Gβ regulates coupling between actin oscillators for cell polarity and directional migration. PLoS Biology. 14(2):e1002381.
12. Ding J, Segarra VA, Chen S, Cai H, Lemmon SK, Ferro-Novick S. (2016) Auxilin facilitates membrane traffic in the early secretory pathway. Molecular Biology of the Cell. 27(1), 127-136.
13. Santhanam B, Cai H, Devreotes PN, Shaulsky G, and Katoh-Kurasawa M. (2015) The GATA transcription factor GtaC regulates early developmental gene expression dynamics in Dictyostelium. Nature Communications. 6:7551.
14. Gao R, Zhao S, Sun Y, Zhao S, Gao J, Borleis J, Willard S, Tang M, Cai H, Kamimura Y, Huang Z, Mogilner A, Pan T, Devreotes PN, Zhao M. (2015) A large-scale screen reveals genes that mediate electrotaxis in Dictyostelium discoideum. Science Signaling. 8(378):ra50.
15. Zhang H, Zhao X, Li J, Cai H, Deng X, Li L. (2014) MicroRNA408 is critical for the HY5-SPL7 gene network that mediates the coordinated response to light and copper. Plant Cell. 26(12), 4933-4953.
16.Cai H, Katoh-Kurasawa M, Muramoto T, Santhanam B, Long Y, Li L, Ueda M, Iglesias PA, Shaulsky G, Devreotes PN. (2014) Nucleocytoplasmic shuttling of a GATA transcription factor functions as a development timer. Science. 343(6177): research article 1249531.
17.Cai H, Huang CH, Devreotes PN, Iijima M. (2012) Analysis of chemotaxis in Dictyostelium. Methods in Molecular Biology. 757, 451-468.
18. Chen S, Cai H, Park SK, Menon S, Jackson CL, Ferro-Novick S. (2011) Trs65p, a subunit of the Ypt1p GEF TRAPPII, interacts with the Arf1p exchange factor Gea2p to facilitate COPI-mediated vesicle traffic. Molecular Biology of the Cell. 22(19), 3634-3644.
19.Cai H, Das S, Kamimura Y, Long Y, Parent CA, Devreotes PN. (2010) Ras-mediated activation of the TORC2-PKB pathway is critical for chemotaxis. Journal of Cell Biology. 190(2):233-245.
20. Lynch-Day MA, Bhandari D, Menon S, Huang J, Cai H, Bartholomew CR, Brumell JH, Ferro-Novick S, Klionsky DJ. (2010) Trs85 directs a Ypt1 GEF, TRAPPIII, to the phagophore to promote autophagy. PNAS. 107(17), 7811-7816.
21. Cai Y, Chin HF, Lazarova D, Menon S, Fu C, Cai H, Sclafani A, Rodgers DW, De La Cruz EM, Ferro-Novick S, Reinisch K. (2008) The structure basis for activation of the Rab Ypt1p by the TRAPP membrane tethering complexes. Cell. 133(7), 1202-1213.
22.Cai H, Yu S, Menon S, Cai Y, Lazarova D, Fu C, Reinisch K, Hay JC, Ferro-Novick S. (2007) TRAPPI tethers COPII vesicles by binding the coat subunit Sec23p. Nature. 445(7130):941-944.
23.Cai H, Zhang Y, Pypaert M, Walker L and Ferro-Novick S. (2005) Mutants in trs120 disrupt traffic from the early endosome to the late Golgi. Journal of Cell Biology. 171(5):823-833.
综述 (#corresponding)
1. Sun S*, Zhao G*, Jia M*, Jiang Q*, Li S*, Wang H*, Li W*, Wang Y*, Bian X#, Zhao YG#, Huang X#, Yang G#, Cai H#, Pastor-Pareja JC#, Ge L#, Zhang C#, Hu J#. (2024) Stay in touch with the endoplasmic reticulum. Sci China Life Sci. 67(2):230-257.
2.Cai H and Devreotes PN. (2011) Moving in the right direction: How eukaryotic cells migrate along chemical gradients. Seminars in Cell and Developmental Biology. 22(8), 834-841.
3. Kamimura Y, Cai H, Devreotes PN. (2010) TORC2 and chemotaxis in Dictyostelium discoideum. The Enzymes. 28, 125-142.
4.Cai H, Reinisch K, Ferro-Novick S. (2007) Coats, Tethers, Rabs, and SNAREs work together to mediate the intracellular destination of a transport vesicle. Developmental Cell. 12(5):671-682.
(资料来源:蔡华清研究员,2024-03-19)
-
 杨艺红,博士
杨艺红,博士2010年毕业于河北师范大学,获得博士学位;2010-2013年,生物物理所助理研究员;2013-2017年,清华大学博士后。2017年加入实验室,现为课题组副研究员,专注于细胞迁移及巨胞饮作用中细胞极性建立和维持机制的研究。
-
 王海彬,博士
王海彬,博士本科毕业于中国农业大学,2013年在北京生命科学研究所获得博士学位,2015年赴德国莱布尼茨分子药物研究所进行博士后训练。2019年加入实验室,现为课题组副研究员,专注于巨胞饮调控网络和生理功能的研究。
-
 林亚静,科研秘书
林亚静,科研秘书 -
 涂慧,博士
涂慧,博士本科毕业于南京农业大学。2016年加入实验室,2021年获得博士学位,博士课题聚焦巨胞饮体的形成和成熟机制。现为联合培养博士后。
-
 袁野
袁野袁野本科毕业于山东大学,于2018年加入实验室,现进行巨胞饮作用及溶酶体损伤修复相关机制的研究。
-
 缪茜琳
缪茜琳缪茜琳本科毕业于华中科技大学,于2019年加入实验室,对巨饱饮的调控机制感兴趣,正在探究磷脂酰肌醇信号和泛素修饰对巨胞饮过程的调控。
-
 王志萌
王志萌王志萌本科毕业于中国农业大学,于2019年加入实验室,正在探索内吞体/巨胞饮体成熟过程中的蛋白质分选过程。
-
 邹松霖
邹松霖邹松霖本科毕业于北京科技大学,于2020年加入实验室,专注于研究细胞内吞过程中货物回收的分子机制。
-
 赵鑫
赵鑫赵鑫在中山大学获得硕士学位,于2024年9月加入实验室,正在学习并探索感兴趣的方向。
-
 冯诺
冯诺冯诺本科毕业于中国科学院大学,2023年在实验室做毕设,于2024年正式加入实验室,目前主要探究内吞过程中溶酶体膜完整性维持机制。
-
 杨鹃
杨鹃杨鹃本科毕业于云南大学,于2023年加入实验室,对细胞如何感知营养、如何应对环境变化来调节巨胞饮相关问题感兴趣。
-
 尹彬彬
尹彬彬尹彬彬本科毕业于中国科学院大学,于2023年加入实验室,目前在研究巨胞饮调控的分子机制。
-
 叶舒丹
叶舒丹叶舒丹本科毕业于北京师范大学,于2024年9月加入实验室。
-
 郝亚洲
郝亚洲2016-2021 郝亚洲本科毕业于吉林大学,其博士课题主要围绕巨胞饮调控基因的筛选和机制研究。毕业后他进入生物制药公司从事肿瘤治疗相关抗体药物的研发工作。
-
 李栋
李栋2016-2022 李栋本科毕业于兰州理工大学,通过中国科学技术大学与中科院生物物理所联合培养项目加入实验室,其博士课题聚焦于细胞迁移过程中极性调控的机制研究。目前在美国加州大学旧金山分校进行博士后训练。
-
 张奕玮
张奕玮2017-2021 张奕玮硕士毕业于南开大学,其博士课题围绕细胞巨胞饮和营养摄取的调控机制。毕业后在生物物理研究所从事线粒体DNA编辑和线粒体疾病相关的科研工作。
-
 王若弃
王若弃2017-2022 王若弃本科毕业于首都师范大学,其博士工作利用纳米磁颗粒和蛋白邻位标记技术研究参与调控巨胞饮体-内质网接触位点的蛋白质的功能。目前在美国匹兹堡大学进行博士后训练。
-
 孙飞飞
孙飞飞2017-2023 孙飞飞通过中国科学技术大学与中科院生物物理所联合培养项目加入实验室,其博士课题围绕氨基酸转运蛋白在巨胞饮体成熟过程中的调控机制研究。现为郑州市某重点中学生物竞赛教练。
-
 郭虎
郭虎2017-2023 郭虎,本科毕业于东北林业大学,其博士工作围绕哺乳动物细胞中巨胞饮作用调控因子的筛选和功能研究。毕业后进入广州国家实验室进行博士后训练。
-
 晁晓婷
晁晓婷2017-2024 晁晓婷,本科毕业于西北大学,其博士期间的工作研究RasGAP复合体在巨胞饮体形成过程中的调控作用。毕业后进入空军军医大学西京医院开启博士后训练。
-
 陈茜茜,博士
陈茜茜,博士在生物物理所获得博士学位,2016-2021年为实验室助理研究员,课题围绕哺乳动物细胞巨胞饮调控机制 。