2021年6月25日,中国科学院生物物理研究所叶克穷课题组和北京生命科学研究所杜立林课题组合作在《The EMBO Journal》发表了题为"Molecular and structural mechanisms of ZZ domain-mediated cargo selection by Nbr1"的论文。论文发现了裂殖酵母自噬受体Nbr1的两个新货物,并揭示了Nbr1如何通过单个ZZ结构域识别两个不同蛋白质的结构机制。
自噬是将细胞质物质运送至溶酶体的过程,该过程对维持细胞稳态至关重要。根据不同的底物特异性,自噬可分为非选择性和选择性的,在选择性自噬中,货物被自噬受体特异性识别。北生所杜立林实验室2015年在裂殖酵母中发现一种新型的选择性自噬通路,这个被称为NVT(Nbr1-mediated vacuolar targeting)通路利用自噬受体Nbr1把胞质水解酶Ape2和Lap2转运到液泡中。和经典的巨自噬通路不同,NVT通路依赖于内体的运输机器,并不形成自噬小体。目前发现了多种自噬受体,但它们如何特异识别货物还不清楚。
该研究首先发现Nbr1能结合两个新的货物蛋白质--甘露糖苷酶Ams1和氨基肽酶Ape4,还确定了这两个蛋白质竞争性的结合在Nbr1的第一个ZZ 结构域。研究者利用冷冻电镜技术分别解析了Ams1和Ape4结合Nbr1-ZZ1复合物的结构,发现Nbr1的ZZ1结构域不仅通过保守的酸性口袋识别货物肽链的N端,也通过货物特异性的界面识别货物。研究者还利用突变实验证实了两个结合界面的重要性。这项研究揭示了在自噬受体Nbr1结合货物的过程中利用单个ZZ结构域识别两个底物的双重特异性的机制,扩大对ZZ结构域识别蛋白质模式的认识。
该工作由中国科学院生物物理研究所和北京生命科学研究所合作完成,生物物理所叶克穷研究员和北生所杜立林研究员为论文的通讯作者,北生所博士生王影影和生物物理所博士生张建秀为论文的共同第一作者。该研究得到了国家自然科学基金委、中国科学院战略性先导计划、国家科技部重点研发计划和北京市政府等的资助。
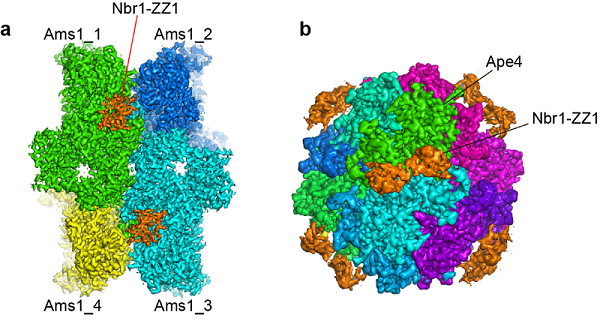
图:Ams1-Nbr1和Ape4-Nbr1复合物的冷冻电镜结构
文章链接: https://doi.org/10.15252/embj.2020107497
(供稿:叶克穷研究组)
