2018年11月29日,《Cell》杂志在线发表了中国科学院生物物理研究所王艳丽课题组和章新政课题组合作的研究论文“Structure Studies of the CRISPR-Csm Complex Reveal Mechanism of Co-transcriptional Interference”。该工作解析了不同状态的III-A型CRISPR-Cas系统效应复合物Csm的结构,并结合体内和体外的功能实验,系统地阐述了III型CRISPR-Cas系统抵御外源核酸的分子机制。王艳丽课题组一直致力于CRISPR-Cas系统抗病毒作用机理的研究,前期研究揭示了重要作的CRISPR-Cas系统作机理(Nature 2014, Cell 2015, Cell Res. 2016, Cell 2017a, Cell 2017b, Mol. Cell 2017);这也是王艳丽组和章新政组长期合作 (Cell Res 2016, Cell 2017b),取得的另一重大突破。
CRISPR-Cas系统是原核生物中广泛存在的一种由RNA介导的获得性免疫系统。其中,III型CRISPR-Cas系统是目前发现的所有CRISPR-Cas系统中最古老、最复杂的一类。III型CRISPR-Cas系统中的A亚型具有一个称为Csm的效应复合物,它由多个Cas蛋白与crRNA共同组成。不同于其它CRISPR 效应复合物,Csm复合物不仅能够切割与crRNA互补的目的RNA,而且目的RNA的结合可以激活Csm复合物产生两种新的酶活性,即转录过程中的ssDNA的切割以及合成环状寡聚腺苷酸(cOA)的活性。cOA作为第二信使可以激活Csm6,非特异性降解RNA。但是,目前III-A型CRISPR-Cas系统的Csm效应复合物组装方式、识别“自我”与“非我”DNA,以及激活Csm1的DNA酶和腺苷酸环化酶的活性等分子机理仍不清楚。
该项研究报道了嗜热链球菌(Streptococcus thermophilus)III-A型效应复合物Csm的高分辨率晶体结构,以及Csm与不同类型的目的RNA及ATP的七种不同底物结合状态的、近原子分辨率的冷冻电镜结构。研究表明Csm复合物由Csm1-5五种蛋白亚基和一条crRNA共同组成,并发现Csm复合物的组成将随着crRNA的长度变化而发生变化,但是5种Csm蛋白的组成一直遵循Csm112n3n+14151的规律。该研究选取了3’互补以及非互补的目的RNA,发现目的RNA与crRNA在(-2)-(-5)位是否互补配对是激活Csm1切割ssDNA以及合成cOA的关键因素。而且,研究发现3’非互补的目的RNA的结合导致Csm1局部区域的构象变化,从而通过别构效应激活Csm1的DNA酶和腺苷酸环化酶的活性。该研究是CRISPR-Cas系统抗病毒机理的又一重大突破,进一步阐明多蛋白组成的效应复合物识别和切割外源核酸的分子机制,并为开发III型CRISPR系统作为应用工具打下重要的理论基础。
中国科学院生物物理所王艳丽研究员和章新政研究员为该文的共同通讯作者。王艳丽组的尤李兰(博士生)、王久宇(副研究员)及章新政组的马军(副研究员)为本文的共同第一作者,该研究得到科技部、国家自然科学基金、中国科学院战略性先导科技专项(B类),以及HHMI-Wellcome基金的资助,上海同步辐射光源、生物物理所生物成像中心和同位素实验室为该研究提供了重要的技术支持。
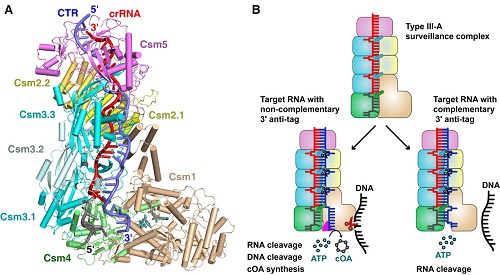
III-A型CRISPR-Cas系统中Csm复合物的结构生物学研究。
A. Csm-cognate target RNA-AMPPNP复合物的电镜结构。
B. III-A型CRISPR-Cas系统抵御外源核酸入侵的模式图。
文章链接:https://www.cell.com/cell/fulltext/S0092-8674(18)31451-X#%20
供稿:王艳丽课题组
