2018年6月25日和8月17日,《Nature chemical biology》在线发表了王江云课题组与德州大学圣安东尼奥分校刘爱民课题组的研究论文“Cleavage of a carbon–fluorine bond by an engineered cysteine dioxygenase”及王江云课题组和山东大学孙金鹏课题组合作的题为“Allosteric mechanisms underlie GPCR signaling to SH3-domain proteins through arrestin”的研究文章。工作通过使用遗传密码扩展的技术,发现了C-F 键可以被半胱氨酸双加氧酶催化断裂的研究。通过基因编码二氟酪氨酸在GPCR信号转导研究中取得了新的进展。
氟在生物医药领域有着广泛的应用。氟化物可用于牙膏和饮用水中以防止蛀牙,其也被药物化学家广泛用于生产抗生素,抗抑郁药,类固醇和其他药物 。和导致类风湿性关节炎,乳腺癌,阿尔茨海默氏症和帕金森病等疾病相关的半胱氨酸双加氧酶(CDO) 可以调节机体的硫醇水平。当体内半胱氨酸太多时,CDO会迅速从体内清除半胱氨酸。研究人员用实验室合成的二氟代酪氨酸取代了CDO cofactor 的酪氨酸。这在CDO中产生了两个非常强的碳-氟键,取代了两个弱得多的碳-氢键。高精度质谱,核磁共振光谱和X射线晶体结构测定观察到CDO仍然能够打破其碳-氟键以产生成熟cofactor。这是科学家首次在酶的氧化催化中发现碳-氟键的裂解(断裂)。虽然药物化学家在药物治疗中广泛使用氟化物,这个发现启示我们氟化学是非常复杂的,氟化物可能在人体内被降解。该工作由中国科学院生物物理研究所王江云课题组与德州大学圣安东尼奥分校刘爱民课题组合作完成。王江云课题组已毕业学生李家松为论文第一作者。
G蛋白偶联受体(GPCR)是非常重要的药物靶点,30%的临床处方药的直接靶点都是GPCR。虽然GPCR具有极其重要的功能,但其信号转导的规律还没完全阐释清楚。课题组利用基因密码子扩展技术及19F-NMR方法系统阐释了800多个GPCR 与下游含有SH3结构域的近300个蛋白(SH3-domain containing proteins,SH3-CPs)之间的信号转导规律,不仅发现重要信号转导分子Arrestin的3个多聚脯氨酸是GPCR联系下游 SH3结构域蛋白的停靠码头(Docking sites),还发现别构调控是介导Arrestin与下游SH3结构域蛋白的主要机制。利用体外重构实验,非天然氨基酸标记,荧光淬灭及BRET方法证明GPCR与β-arrestin-1复合物能够激活下游的SH3-CPS,如SRC,其作用机制也是通过别构调控作用完成的。研究揭示了GPCR与SH3-CPs之间的作用机制,主要包含两个层面的别构调节,第一是通过GPCR磷酸化编码,别构调控arrestin ,进而招募不同的SH3-CP,传递下游信号。第二个层面是GPCR与arrestin复合物可以与SH3-CPs 蛋白如SRC蛋白结合,通过别构调控机制将其激活,发挥其下游生理功能。这项研究打破了Arrestin只具有接头蛋白(adaptor)的功能的传统观念。该工作由中国科学院生物物理研究所王江云课题组和山东大学孙金鹏课题组合作合作完成。王江云研究员和孙金鹏教授为本文的共同通讯作者,联合培养学生杨帆为本文的第一作者,山东大学肖鹏博士和联合培养学生屈昌秀,刘琪为共同一作。该工作得到了国家自然科学基金,国家973计划、重点研发计划及中科院基金的资助。
文章链接:
https://www.nature.com/articles/s41589-018-0085-5;
https://www.nature.com/articles/s41589-018-0115-3
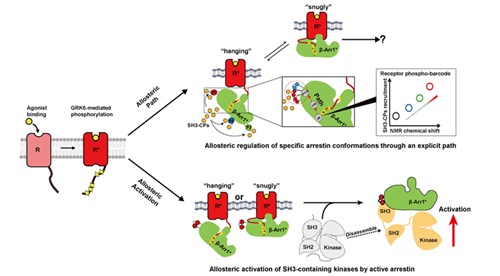
图1、GPCR通过和β-arrestin-1形成的复合物的别构调控激活下游信号通路

图2、F2-Tyr157 CDO.晶体结构
