绿色荧光蛋白(GFP)的发明因其能够提供对于活细胞和活体动物的靶向基因修饰标记而获得2008年诺贝尔化学奖。进一步,由基因改造的光激活荧光蛋白(PAGFP)能够提供单分子特性,而实现了超分辨显微成像,使得这一技术获得2014年诺贝尔化学奖。随后,超高分辨显微成像技术的发展向着活细胞动态超高时空分辨率显微成像迈进。其中,光学波动超高分辨成像技术(SOFI)是一种简单可行的活细胞超高分辨显微成像新技术,它利用特殊荧光蛋白(或者染料)的反复光开关特性以及成像像素点随时间的波动和相关特性进行成像,因其可以突破单分子发光限制,同时实现多个荧光分子高速成像而迅速成为国际关注的热点。
发展新型荧光蛋白并用于超高分辨显微成像研究是中科院生物物理所徐平勇课题组的重要研究方向。在前期发展的新型重要光激活荧光蛋白mGeos(PNAS,2012)和光转化荧光蛋白mEos3.1/mEos3.2(Nature Methods,2012)的基础上,徐平勇课题组与华中师范大学的彭建新课题组以及北京大学席鹏课题组合作,于2015年2月19日在ACS Nano上在线发表了一种新型反复光激活绿色荧光蛋白kylan-S,可用于高速活细胞超分辨率显微成像。这一荧光蛋白与现有的适用于SOFI成像的Dronpa相比具有突出的优点:在波动(fluctuation)状态下的荧光亮度比Dronpa高6-8倍,波动动态范围高4倍,同时具有极高的光学稳定性。同时,Skylan-S是一种单体,因此能够用于活细胞成像而不影响目标蛋白的定位和功能。基于这些特性,Skylan-S应用于SOFI超分辨成像中具有极高的时空分辨率。在SOFI成像中,获得了1.5秒的超高时空分辨率成像(每帧3毫秒,500帧进行SOFI重构),可利用4阶SOFI获得clathrin-coated pits(CCP)的环状结构结构,空间分辨率好于100nm。同时,Skylan-S能够动态观察亚细胞结构60s以上。而Dronpa在第一帧就无法实现这一高分辨率,在30s中超过一半基本被漂白。利用Skylan-S和Dronpa分别标记细胞的肌动蛋白丝,Skylan-S能够以丰富灰阶显示不同标记浓度的蛋白丝的精细结构,而Dronpa则仅能提供信噪比非常有限的图像。另外,Skylan-S在较高能量的488纳米激光照射下具有很好的单分子特性,适用于PALM成像。同时,它也广泛适用于传统的共聚焦和双光子成像。
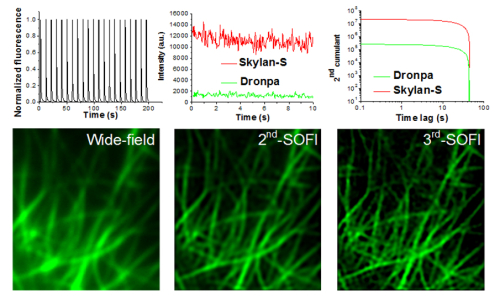
图示、在SOFI成像条件和波动状态下,Skylan-S具有比Dronpa更高的荧光强度和涨落范围,使其更适合于高阶SOFI超分辨显微成像。
徐平勇研究员、华中师范大学的彭建新教授和北京大学的席鹏研究员为本文的通讯作者;生物物理所与华中师范大学生科院联合培养的博士生张茜和北京大学的博士生陈轩泽为共同第一作者。该工作受到国家“973”计划、国家重大仪器发展专项、国家自然科学基金、北京市自然科学基金、中科院基金先导项目等的资助。
论文链接:http://pubs.acs.org/doi/abs/10.1021/nn5064387
(供稿:徐平勇课题组)
