2012年3月11日, 中国科学院生物物理所秦燕研究员指导的一项科研成果登上了国际权威学术杂志《自然:结构和分子生物》(Nature Structural & Molecular Biology) 最新一期的电子版。该文章标题为“A conserved proline switch on the ribosome facilitates the recruitment and binding of trGTPases”(10.1038/nsmb.2254),报道了核糖体招募翻译因子的重要分子机理。这项研究工作与同所的龚为民研究员、许瑞明研究员,德国马普学会分子遗传研究所K. H. Nierhaus教授合作完成。
核糖体是蛋白质翻译工厂,信使RNA上携带的遗传信息在这里被翻译成蛋白质。完成蛋白质的生物合成过程需要核糖体和众多翻译因子协调完成,核糖体招募翻译因子的过程错综复杂,一直以来没有定论。
秦燕研究组研究发现,在核糖体的翻译因子结合部位,存在一个脯氨酰开关(Proline Switch), 它的构象决定核糖体对翻译因子的招募与否。深入研究发现,控制该开关的酶就是翻译因子。因此,核糖体与翻译因子之间存在着对彼此的共调控。而这种调控关系,在所有的蛋白质翻译G蛋白(trGTPase)与核糖体之间存在,说明其具有普遍意义:在翻译的全部过程中,包括起始、延长、终止和再循环,都由这个脯氨酰开关调控招募翻译G蛋白。
该项研究工作得到了国家科技部、国家基金委、中国科学院的资助。
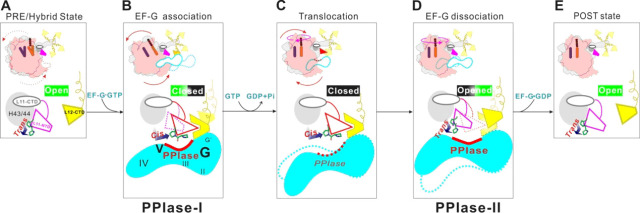
图:核糖体蛋白质L11上的脯胺酰开关(Proline Switch 22, PS22)及其调控机理。
PS22-trans (OFF), PS22-cis (ON).PS22负责招募翻译因子G蛋白家族,而调节PS22的‘手’是翻译G蛋白家族的全部成员。
PS22和翻译G蛋白家族具有‘互调控’的关系。
(供稿:秦燕课题组)
