近日,毕利军课题组在Nucleic Acids Research杂志上发表题为“The dimer state of GyrB is an active form: implications for the initial complex assembly and processive strand passage”的研究论文。这是继揭示拓扑异构酶的DNA结合活性和解析拓扑异构酶的晶体结构之后的另一个系列研究成果。
2006年该课题组首次揭示了拓扑异构酶的DNA结合活性和关键氨基酸,结果发表在Nucleic Acides Research,2006上。在2009年,王大成和毕利军课题组合作完成了拓扑异构酶B亚基的晶体结构解析,在Nucleic Acids Research杂志上发表题为“Crystal structure of DNA gyrase B’ domain sheds lights on the mechanism for T-segment navigation”的研究论文,并入选Faculty of 1000 Biology(2010),获得推荐和点评。在此之前,对于DNA链如何穿越到达待校正DNA这一基本的拓扑结构功能的动态过程的了解处于空白状态,该项研究结果为解惑此问题建立了新的结构基础,获得了新发现,提出了新认识,从而具有重要的基础理论意义。同时,由于Gyrase B’对病原菌的生存至关重要,其精细结构对提供研发广谱的相关药物,特别是抗生素的靶标,具有应用前景。
在以前的研究中,提出了结核分枝杆菌的DNA旋转酶B’结构域(GyrB C端结构域)的二聚体结构并提出了一个“水闸”的T段运输模式。但是仍然不能很好地解释二聚体结构的作用。新的研究结果中交联和分析超离实验表明,二聚体既存在于B’蛋白中也存在于全长GyrB中。交联二聚体的GyrB与GyrA的亲和力较弱,但是GyrB在单体状态下与双链DNA的亲和力比单链DNA高。使用交联法和far-western分析发现,GyrB以二聚体状态参与GyrA-GyrB-DNA三元复合物,表明GyrB的二聚体结构是一个活性形式,二聚体状态是三元复合物形成所必需的。突变研究结果表明,二聚体的结构代表了DNA解旋前的状态。此外,这些结果表明二聚体形式的GyrB是一种功能构象,在酶的催化反应中发挥重要功能,二聚体结构不仅存在于催化反应之前的复合物中,还可能在穿链之后连接之前出现,这可能为持续性穿链提供了结构基础。此研究还构建出DNA旋转酶B’区域初始复合物的模型(如图1)。
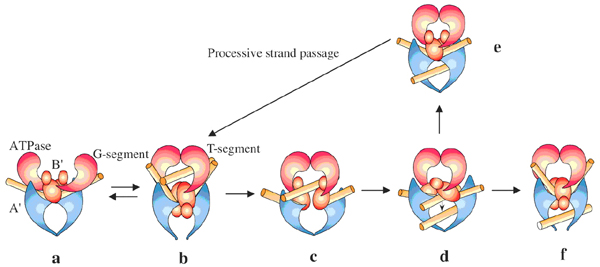
图1:在a中GyrB的二聚体结构(ATP酶和B’ 区域)和A’区域连接G段形成了最初的复合物,b-c-d-e-b形成了一个连续的循环过程,在f中G段重新封好,T段从出口剔除。这一假定的机制很可能为DNA旋转酶中的持续转运提供结构基础,而且这一机制可能适用于拓扑异构酶IV的持续合成过程。该研究结果发表在“核酸研究”(Jinjun Wu,et al. Nucleic Acids Research, 2011, 1-15.)
