果糖是最常见的食品甜味添加剂,被广泛应用于含糖饮料、糖果和烘焙食品的加工。在过去200年间,人类对于果糖的摄入量增长超过100倍。过量摄入果糖与肥胖、糖尿病和脂肪肝等代谢性疾病发生密切相关。流行病学研究结果表明摄入过量果糖会增加罹患结直肠癌的风险,然而,一直没有研究揭示果糖在结直肠癌进展中的功能和机制。2018年,卜鹏程团队研究成果首次证明高果糖饮食能促进结直肠癌的肝转移,结直肠癌细胞利用肝脏中丰富的果糖作为能源,促进其在肝脏中的定植和生长(Cell Metabolism,2018)。随后,多项研究也报道过量摄入果糖会促进结直肠癌、胰腺癌、肝癌、乳腺癌、前列腺癌和急性髓系白血病的发生和发展。上述工作都关注的是果糖直接作用于肿瘤细胞通过代谢途径促进肿瘤的生长。
2024年10月28日,中国科学院生物物理研究所卜鹏程、温州医科大学沈贤和中国科学院大连化学物理研究所朴海龙团队合作在《Cell Metabolism》杂志上发表题为Hexokinase 2 senses fructose in tumor-associated macrophages to promote colorectal cancer growth的研究论文。该研究发现果糖抑制M1型肿瘤相关巨噬细胞(M1-like tumor-associated macrophages,M1-like TAMs)的极化进而促进结直肠癌的发生和发展。有意思的是,果糖对于巨噬细胞极化的抑制作用并不依赖于其下游代谢物,而是通过直接促进己糖激酶(HK2)和肌醇1,4,5-三磷酸受体Ⅲ型(ITPR3)的相互作用。该研究揭示了果糖发挥功能的新机制,果糖本身可以作为调控巨噬细胞极化的信号分子。
研究团队利用多种小鼠结直肠癌模型发现高果糖饮食通过下调肿瘤微环境中巨噬细胞尤其是M1-like TAMs的比例,促进小鼠结直肠癌的发生和生长。敲除髓系细胞中果糖特异性转运蛋白GLUT5能够逆转果糖对M1-like TAMs极化的抑制作用,并且抑制原位结直肠癌的生长。机制研究发现果糖不是通过果糖激酶KHK及其下游代谢物抑制M1-like TAMs极化,而是作用于己糖激酶HK2,促进其与内质网Ca2+转运通道蛋白ITPR3结合,减少线粒体相关内质网膜(MAM)的形成并降低细胞质基质和线粒体中Ca2+浓度。一方面,果糖通过下调细胞质基质中的Ca2+浓度,抑制p38和STAT1的磷酸化以及p65入核,进而抑制M1-like TAMs极化。另一方面,果糖通过下调线粒体中的Ca2+浓度,降低线粒体中的ROS水平,抑制NLRP3炎症小体的活化,从而抑制巨噬细胞对肿瘤细胞的杀伤功能。
结直肠癌患者肿瘤单细胞转录组测序分析结果表明,GLUT5高表达的巨噬细胞亚群中M1-like TAMs相关标志物的水平显著低于GLUT5低表达的巨噬细胞亚群。巨噬细胞中GLUT5表达水平与患者的分级呈正相关,而与患者存活时间呈负相关。
该研究揭示了果糖作为信号分子通过抑制M1-like TAMs极化促进结直肠癌发生和生长的新功能,丰富了果糖调控细胞活性的作用机制。
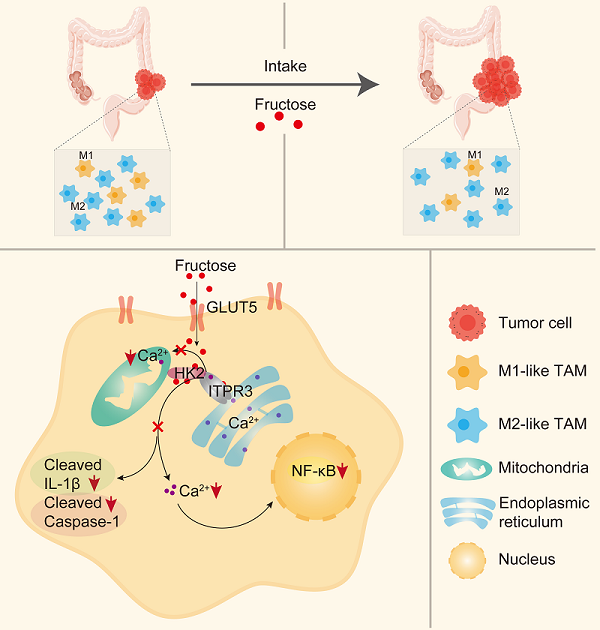
图:高果糖饮食促进结直肠癌进展的机制图
中国科学院生物物理研究所卜鹏程研究员、温州医科大学沈贤教授和中国科学院大连化学物理研究所朴海龙研究员为论文的共同通讯作者。卜鹏程课题组晏荟文助理研究员,首都医科大学附属北京朝阳医院王智博士(卜鹏程课题组毕业博士生),解放军总医院腾达博士,温州医科大学陈孝东博士为论文共同第一作者。中国科学院生物物理研究所卜鹏程组博士生朱子敬、朱冰组博士生卫子源、朱平组王有望博士,中国科学院微生物研究所朱明昭组柴谦副研究员,中国科学院大连化学物理研究所陈欢博士和王稳博士为该研究提供了帮助。该研究得到了国家自然科学基金委、北京市自然科学基金委和中国科学院的经费支持。
文章链接:
https://www.cell.com/cell-metabolism/fulltext/S1550-4131(24)00398-X
(供稿:卜鹏程研究组)
 附件下载:
附件下载: