哺乳动物卵细胞受精后形成的受精卵会经历DNA甲基化的重编程,将继承自亲本的基因组甲基化状态重置,为后续的组织分化、胚胎发育做准备。DNA甲基化重编程的异常可能会导致胚胎发育异常、子代的生理缺陷等问题。在早期胚胎发育的DNA甲基化重编程过程中,基因组会表现出大范围的DNA去甲基化。DNA复制依赖的被动去甲基化是其主要驱动力。DNA甲基化维持的重要DNA甲基转移酶DNMT1(DNA methyltransferase 1)及其辅助蛋白UHRF1在卵细胞和早期胚胎中的细胞质滞留被认为是这一时期基因组发生DNA被动去甲基化的主要原因。双加氧酶TET(Ten-eleven translocation)家族蛋白能够通过将5-甲基胞嘧啶(5mC)连续氧化,产生5-强甲基胞嘧啶(5hmC),5-醛基胞嘧啶(5fC),和5-羧基胞嘧啶(5caC)。这些氧化产物既可以随着DNA复制逐渐还原成胞嘧啶,也可以通过剪辑切除修复机制还原成胞嘧啶。后者由于不依赖于DNA复制,被称为DNA主动去甲基化。其中,TET3是卵细胞中唯一表达的TET蛋白,其介导的特定区域的主动去甲基化也帮助了早期胚胎的DNA甲基化重编程。TET3的缺陷会导致子代代谢异常,出现糖尿病易感问题。尽管全基因组范围DNA去甲基化是早期胚胎发育过程中DNA甲基化重编程的主要特征,进一步的研究发现在这一阶段同时存在着重要区域DNA甲基化的维持,例如印记基因和反转录元件等。母源缺失DNMT1导致这些区域DNA甲基化无法在DNA甲基化重编程过程中维持,进而引起后续胚胎发育异常和致死。除此之外,一些研究发现受精后还会发生依赖于DNMT1和DNMT3A的从头DNA甲基化建立。早期胚胎DNA甲基化重编程的过程存在着以上诸多不同的DNA甲基化调控事件,直接参与其中的蛋白,如DNMT1,UHRF1等的功能也有很多研究。然而,这些蛋白是如何被调控,并在DNA甲基化重编程过程中发挥适当作用的机制仍有待阐明。
中国科学院生物物理研究所朱冰研究组于2024年8月25日在《Nature Communications》期刊在线发表了题为"Pramel15 facilitates zygotic nuclear DNMT1 degradation and DNA demethylation"的研究工作。该研究发现小鼠母源蛋白Pramel15能够通过降解受精卵细胞核中的DNMT1,控制细胞核中DNMT1蛋白水平,首次揭示了早期胚胎细胞核中存在着依赖于蛋白酶体的DNMT1调控机制,帮助受精后合子DNA去甲基化。
该研究团队在前期研究中从小鼠卵细胞的cDNA文库中筛选鉴定到一个新型的DNA甲基化调控基因Pramel15。在体细胞中过表达Pramel15会通过降解DNMT1干扰DNA甲基化在DNA复制过程中的维持。在HEK293和小鼠ES细胞中的进一步研究发现,Pramel15作为Cullin5 E3泛素连接酶复合体中的底物识别亚基,通过泛素化-蛋白酶体途径降解DNMT1。值得注意的是,在Cullin5敲除细胞中,Pramel15仍能利用其他的Cullin复合物降解DNMT1,体现了其降解DNMT1能力的稳健性。
为了深入理解Pramel15在早期胚胎发育过程中的作用,研究者构建了Pramel15敲除小鼠。通过对Pramel15缺失的卵细胞和早期胚胎进行DNMT1免疫荧光染色和定量分析,研究者发现受精卵细胞核中的DNMT1蛋白水平上升。并且在用蛋白酶体抑制剂MG132和Cullin泛素化酶复合体抑制剂MLN4924处理过的受精卵中可以观察到相近程度的DNMT1上升,而对Pramel15缺失的受精卵处理后细胞核中的DNMT1水平不会进一步上升。说明在受精卵中存在着主要通过Pramel15介导的DNMT1蛋白酶体降解途径。进一步对卵细胞、受精卵及二细胞胚胎进行全基因组DNA甲基化测序(WGBS)发现,Pramel15缺失会引起全基因组范围DNA甲基化的随机性上升。综上所述,Pramel15可以调节受精卵DNA复制过程中细胞核内DNMT1的水平,从而帮助早期胚胎中的DNA甲基化重编程。
近期有国内外多个研究组发表了关于DNMT1和UHRF1在卵细胞和早期胚胎中细胞质滞留机制的研究,发现SCMC相关蛋白NLRP14和PADI6分别调控了UHRF1和DNMT1的细胞质定位。本研究表明,在早期胚胎发育过程中,除了将DNMT1和UHRF1转运并限制在细胞质中,细胞核中还存在着Pramel15介导的DNMT1蛋白水平控制机制,对DNA甲基化重编程效率进行调控。这一发现体现了早期胚胎中DNA甲基化重编程调控机制的复杂性,也为提高诱导细胞重编程效率等提供了启发。
中国科学院生物物理研究所朱冰研究员和张珠强研究员为论文的通讯作者,朱冰研究组谈家骏博士和李颖峰副研究员是论文的共同第一作者。中国科学院生物物理研究所田勇研究组、中国科学院生态环境研究中心汪海林研究组、美国南佛罗里达大学汪志高研究组参与了合作研究。该研究得到国家自然科学基金、国家重点研发计划、中国科学院、新基石科学实验室和中国科学院青年创新促进会的资助。
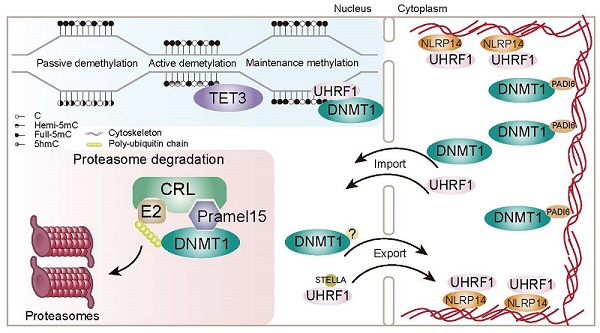
图:早期胚胎发育过程中DNA甲基化重编程的调控机制
文章链接:https://www.nature.com/articles/s41467-024-51614-0
(供稿:朱冰研究组)
 附件下载:
附件下载: