单胺类神经递质包括去甲肾上腺素、肾上腺素、多巴胺、血清素和组胺等,在神经系统和其他组织中发挥着重要的生理作用。其中,在神经系统中,去甲肾上腺素介导调节情绪,认知,疼痛等多种生理功能,同时它也影响大脑注意力和反应行为,诱发“战斗或逃跑”反应。多巴胺在调节运动和奖励方面发挥着重要作用,被认为与帕金森病和精神分裂症等精神疾病有关。而血清素则是"幸福感"的来源,同时也具有调节睡眠节律的作用。囊泡单胺转运蛋白(VMAT2)是中枢神经系统中唯一介导单胺类神经递质储存的转运蛋白。它利用质子的电化学势,以2:1的质子与底物的化学计量比,将神经递质或神经毒素MPP+转运进入囊泡中,在介导神经冲动传递和神经保护方面发挥着至关重要的作用。
前期,中国科学院生物物理研究所赵岩团队与中国科学院物理研究所/北京凝聚态物理国家研究中心姜道华团队合作在国际学术期刊《Nature》发表了题为"Transport and inhibition mechanisms of human VMAT2"的研究工作,揭示了5-HT及VMAT2抑制剂Reserpine、Tetrabenazine、Ketanserin的识别机制及构象转换机制。尽管前期研究在VMAT2结构功能研究方面提供了重要的见解,关于VMAT2如何识别并转运不同化学结构的其它单胺类神经递质以及帕金森病诱导剂MPP+ 的作用机制等问题尚不清楚。另外,质子耦联底物转运的分子机制仍需进一步探究。
2024年5月22日,赵岩团队联合姜道华团队在《Cell Research》在线发表题为"Structural snapshots of human VMAT2 reveal insights into substrate recognition and proton coupling mechanism"的研究论文,该研究报道了人源囊泡单胺转运蛋白 (hVMAT2) 在低pH 下的apo结构,分别结合去甲肾上腺素、多巴胺、组胺、神经毒素MPP+的囊泡腔朝向的复合物结构,和结合去甲肾上腺素的胞质朝向的复合物结构 (图1),揭示了VMAT2识别不同底物的结构基础,并进一步完善了质子耦合底物转运的分子机制。
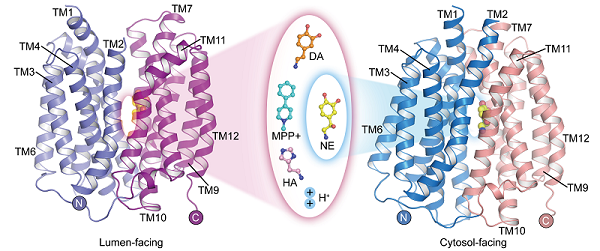
图 1. VMAT2结合神经递质和神经毒素的结构
尽管去甲肾上腺素、多巴胺、血清素和MPP+的分子结构各异,但是结合这些底物的VMAT2复合物结构表明,它们均结合于转运蛋白的相似位置。然而,这些底物分子的某些官能团的细微差异导致其与转运蛋白的相互作用和结合模式呈现出显著且关键的不同。这些差异揭示了VMAT2如何有效地识别不同的底物分子。有趣的是,组胺结合在一个不同于其他底物结合的位置,结合功能实验,研究人员验证了该位点的可靠性。
此外,研究人员报道了在不同构象下去甲肾上腺素与VMAT2结合的结构,包括胞质朝向和囊泡腔朝向的构象。在伴随底物转运的构象变化过程中,N端结构域相对于C端结构域发生了约30°的旋转,交替地将底物结合位点暴露于胞质侧或囊泡腔侧,从而实现底物在囊泡中的富集。尽管VMAT2经历了较大的构象变化,去甲肾上腺素的底物结合口袋在此过程中仍然保持相对稳定,与周围残基的相互作用也没有发生显著变化。这种巧妙的构象转换特点对于VMAT2的功能至关重要。
在前期研究中,研究人员报道了D399残基可能是偶联底物结合与质子化的关键位点,并在N端结构域内发现一个氢键网络。这个氢键网络可能在偶联质子结合,促进VMAT2构象转换中发挥关键作用。通过解析VMAT2在不同pH条件下的结构,确认了D33可能是另一个关键质子化位点。具体而言,D33的质子化可以诱导D33、R189和Q192残基侧链的局部构象变化,破坏了氢键网络,从而推动VMAT2构象从囊泡腔朝向转换为胞质朝向(图2)。
综上所述,该研究深入分析了VMAT2识别具有不同化学结构的单胺类神经递质、神经毒素分子的机制,提出了VMAT2构象变化的分子机制模型,并完善了质子耦联底物转运的具体机理。这些结构及发现为全面理解VMAT2的转运模式提供了宝贵的见解,丰富了人们对于主要协同转运体超家族(MFS)转运底物分子机理方面的认识,并为药物开发和优化奠定了重要基础。
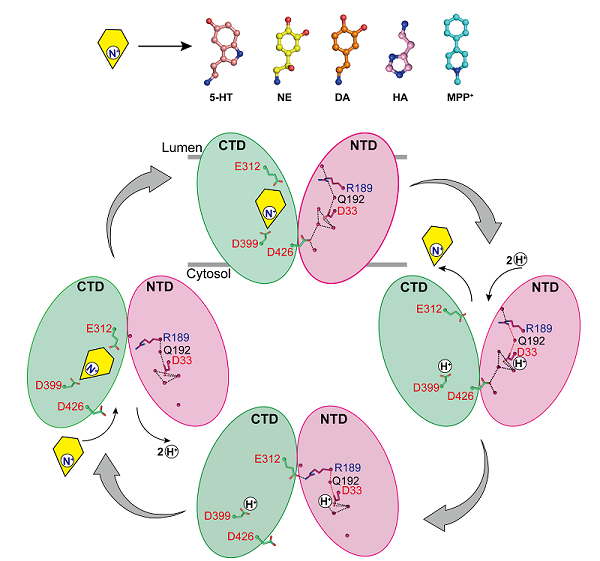
图 2. VMAT2转运单胺机制模型
中国科学院生物物理研究所赵岩研究员和中国科学院物理研究所姜道华特聘研究员为论文的共同通讯作者。中国科学院物理研究所博士生武迪、生物物理研究所博士生于卓亚及陈琦浩、北京大学现代农业研究院赵珺为论文共同第一作者。此外,北京望石智慧黄博,生物物理研究所赵岩组王宇航、苏嘉伟,首都医科大学附属北京朝阳医院李娜也为本研究提供了帮助。
该研究得到中国科学院战略性先导科技专项(B类)和国家自然科学基金的资助。冷冻电镜数据收集得到中国科学院生物物理研究所蛋白质科学研究平台生物成像中心,中国科学院物理研究所SM10组冷冻电镜中心及软物质公共仪器平台、北京大学现代农业研究院生物微观结构研究平台的技术支持。功能实验得到中国科学院生物物理研究所和微生物研究所放射性同位素实验室的帮助。
文章链接:https://www.nature.com/articles/s41422-024-00974-9
(供稿:赵岩研究组)
 附件下载:
附件下载: