作为一类合成、折叠、包装并最终分泌胰岛素的关键执行者,单个胰岛β细胞每分钟产生超过100万个胰岛素分子,约300万个二硫键。由于每对二硫键的生成均伴随一分子过氧化氢(H2O2)的产生,因而β细胞面临巨大的氧化折叠压力。不仅如此,胰岛β细胞内抗氧化物酶活性较低,更容易受到氧化损伤,并在活性氧诱导下发生凋亡,进一步导致胰岛素分泌功能障碍。因此胰岛β细胞的H2O2稳态对于维持细胞活力和胰岛素产生能力至关重要。烟酰胺腺嘌呤二核苷酸磷酸氧化酶4(NADPH oxidase 4,NOX4)是NADPH氧化酶家族的重要成员之一。与其他成员不同,NOX4主要产生H2O2而不是超氧阴离子(O2-)。除此之外,NOX4不依赖上游配体、处于持续活化状态,其活性主要通过蛋白质表达进行调控。然而,尚不清楚分泌旺盛的细胞如何精准调节NOX4的表达和活性,同时将H2O2浓度维持在合适的生理范围内。
2024年3月15日,中国科学院生物物理研究所徐平勇团队在《Redox Biology》杂志在线发表了题为"ER-tethered RNA-binding protein controls NADPH oxidase translation for hydrogen peroxide homeostasis"的研究论文,鉴定了首个负调控NOX4翻译的关键因子EI24,并揭示了EI24通过控制NOX4的翻译精确调控H2O2产生的分子机制,及其对胰岛β细胞氧化还原平衡维持及胰岛素合成的影响。
研究人员发现内质网定位蛋白EI24可以响应H2O2浓度变化,特异性敲除胰岛β细胞中Ei24基因导致细胞中NOX4蛋白表达水平及内质网中H2O2显著增加。进一步通过双荧光报告系统及免疫共沉淀实验,证明EI24通过与RNA结合蛋白RTRAF发生相互作用,将其锚定在Nox4 mRNA的3'UTR区域并抑制其翻译,进而控制H2O2的过量产生(图A)。敲除Ei24导致RTRAF转运至细胞核内,解除对NOX4翻译的抑制作用,并进一步影响下游转录因子MafA的翻译,最终导致MAFA与Ins2启动子结合能力减弱,抑制胰岛素合成,扰乱小鼠血糖代谢水平(图B)。
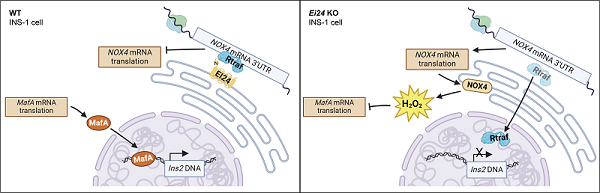
图:EI24与RNA结合蛋白RTRAF和Nox4 mRNA 3'-UTR相互作用抑制INS-1细胞中NOX4翻译机制的示意图
该研究工作揭示了一种新的共翻译调节系统,即内质网蛋白如何通过调节RNA结合蛋白的定位来精确控制膜定位蛋白的mRNA共翻译。这种调控机制具有重要的生理意义,对于维持分泌细胞氧化还原稳态及生物学功能至关重要。
中国科学院生物物理研究所徐平勇研究员和袁琳副研究员为论文的共同通讯作者,博士研究生裴昕彤和王哲为共同第一作者。中国科学院生物物理研究所张宏研究员、陈畅研究员、张晓荣研究员、王磊研究员等对该工作给予了指导和帮助。该研究得到了国家自然科学基金、科技部和中国科学院战略性先导科技专项(B类)等多个项目的支持。
文章链接:https://doi.org/10.1016/j.redox.2024.103126
(供稿:徐平勇研究组)
 附件下载:
附件下载: