家蚕和蜘蛛等泌丝动物拥有类似的纺丝器官和纺丝机制,它们以水溶性蛋白为原料,在常温、常压下通过特定的组装和结构转变,生产出强度和韧性等综合力学性能优异的丝状纤维。
多年来,研究人员一直致力于家蚕和蜘蛛等的天然纺丝机制的研究,希望通过模仿自然界的解决方案,优化和开发纤维制造技术,合成可与天然丝综合力学性能相媲美,甚至超越其性能的人工纤维材料。目前,领域内研究者对家蚕丝素蛋白提出了两种主要的纤维纺丝模型,即"液晶"纺丝(Vollrath, et al., Nature, 2001)和"胶束"纺丝(Jin, et al., Nature, 2003)模型。这两种纺丝模型对家蚕或者蜘蛛丝腺腔中丝蛋白的基本结构单元及其组装过程的认识存在较大不同,其中最主要的差异在于丝腺腔内组成纺丝液的天然丝素蛋白NSF分子所具有的细微结构。"液晶"纺丝模型认为,液晶相纺丝液是由球状丝素蛋白长向聚集形成的类棒状结构组成的;而"胶束"纺丝模型认为,纺丝液是由两亲性的丝蛋白相互聚集形成的胶束结构(100-200 nm)组成的。由于难以准确观察到丝腺腔中天然丝素蛋白的精细结构,两种模型仍然具有较大争议。组成纺丝液的丝素蛋白基本结构单元是以什么形态存在的,这些基本结构单元又是如何组装形成蚕丝或者蜘蛛丝的?这些关键信息的缺失严重阻碍了我们对天然纺丝精巧组装策略的学习和利用。
研究家蚕天然丝素蛋白形态和组装方式最困难的地方在于:在家蚕丝腺腔中,丝素蛋白NSF 能够在15-30% (w/v)的高浓度下保持稳定,而不发生聚集沉淀。但是,一旦脱离体内环境,在体外它们很容易从无规则卷曲结构转变为β-折叠结构,导致蛋白质沉淀变性,最终难以对NSF的结构及组装机制进行研究。这也是绝大部分相关研究都采用再生丝素蛋白(即将茧壳丝煮沸脱去丝胶蛋白后提取的蛋白,其稳定性好但结构不同于天然丝素蛋白),而不采用蚕丝腺腔中天然丝素蛋白NSF 进行研究的原因。
2023年12月29日,中国科学院生物物理研究所朱平研究员团队联合西南大学前沿交叉学科研究院生物学研究中心夏庆友教授、何华伟教授团队在《Science Bulletin》发表了题为"Decoding silkworm spinning programmed by pH and metal ions"的合作研究论文。研究者通过大量筛选,找到了一种在体外使NSF不变性并保持其体内结构的方法,并在此基础上对家蚕丝腺腔中NSF 的形态和结构、以及可能的控制因素进行了较为系统和细致的研究。研究发现,组成家蚕纺丝液的基本结构单元是沉降系数为5.8 S,直径约4 nm的柔性纳米纤维,而不是胶束结构(100-200 nm)或者球状丝蛋白的长向聚集体。在金属离子的诱导下,丝素蛋白多肽链可逆地折叠成以无规则卷曲结构为主的纳米纤维高级结构。从家蚕后部丝腺(posterior of silk gland, PSG)到前部丝腺(Anterior of silk gland, ASG),pH连续降低导致丝素蛋白纳米纤维疏水性增加,诱导水分子与NSF 发生分离,使丝素蛋白由纳米纤维溶液转变成凝胶状,提高纺丝液的浓度并促进纤维的形成。更为重要的是,研究者发现从后部丝腺(PSG)到中部丝腺(MSG),以及前部丝腺中后段(ASG-1),丝素蛋白都呈现无序的纳米纤维排列,但在靠近吐丝器的前部丝腺中(ASG-2),丝素蛋白纳米纤维却呈现出平行于纺丝管腔、并组成一种"鱼骨状"的高度有序排列和结构(图1),为最后的纺丝做充分的准备。
综上,该研究揭示了家蚕丝腺腔中由金属离子和pH梯度调控天然丝素蛋白从纳米纤维到"鱼骨状"结构的多尺度、可控自组装机制,为昆虫纺丝和高性能纤维的仿生设计提供了新的见解。
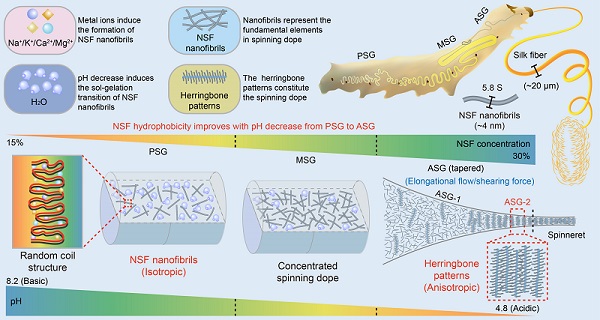
图1. 家蚕纺丝示意图
西南大学前沿交叉学科研究院生物学研究中心与中国科学院生物物理研究所联合培养博士宋凯(现为朱平研究组博士后)为本文第一作者,夏庆友教授、朱平研究员和何华伟教授为本文共同通讯作者。该研究得到科技部、国家自然科学基金委、中国农业农村部、中国科学院等项目的支持。
文章链接:https://doi.org/10.1016/j.scib.2023.12.050
(供稿:朱平研究组)
 附件下载:
附件下载: