天然免疫是机体抵御病原微生物的第一道防线,在清除病原感染和内源危险过程中发挥重要作用。经典的炎症小体(inflammasome)通路通过活化下游的蛋白酶caspase-1,切割底物蛋白GSDMD释放其N端结构域的膜打孔活性,激活细胞焦亡的免疫应答。活化的caspase-1还可以切割另外两个重要的炎症性细胞因子IL-1β和IL-18,成熟的IL-1β与IL-18通过GSDMD在细胞膜上形成的分子孔道分泌到细胞外,发挥其促炎性的生理功能。
细胞内的另一类天然免疫受体caspase-4/5以及小鼠的同源蛋白caspase-11可以直接识别革兰氏阴性菌的脂多糖(LPS)而寡聚激活,通过切割共同的底物蛋白GSDMD也介导细胞焦亡的发生,这一通路被称为非经典炎症小体(noncanonical inflammasome)通路。与经典的炎症小体通路主要存在于天然免疫细胞(如单核/巨噬细胞)有所不同,非经典炎症小体通路还广泛存在于许多非免疫细胞中,表明其重要的免疫防御功能。此外,Caspase-4/5/11已知的生理底物只有GSDMD,是否还有其它在天然免疫中发挥重要功能的底物并不清楚。
2023年11月22日,丁璟珒研究组和北京生命科学研究所邵峰团队在Nature在线发表题为"Recognition and maturation of IL-18 by caspase-4 noncanonical inflammasome"的合作研究论文,发现炎症因子IL-18是非经典炎症小体通路caspase-4/5的生理底物,并进一步揭示了天然免疫通路中caspases识别和活化IL-18的精确分子机制。
研究人员首先发现,前体形式的IL-18 (Pro-IL-18)在许多非免疫细胞系中广泛表达,这些细胞缺少经典炎症小体通路中加工Pro-IL-18的蛋白酶caspase-1,但普遍表达完整的非经典炎症小体通路,利用LPS处理或细菌感染激活胞内的caspase-4,在引起细胞焦亡的同时,也可以介导Pro-IL-18的切割和成熟炎症因子的释放。研究人员进一步利用纯化的重组蛋白在体外生化实验中证明,激活形式的caspase-4可以高效地直接切割Pro-IL-18,其切割位点和caspase-1完全一致,发生在Pro-IL-18前体肽序列(propeptide)的第36位天冬氨酸残基(D36)之后,并且D36之前的四肽序列(LESD)是切割所必需的。
利用痢疾杆菌效应蛋白OspC3特异性结合caspase-4/11的ARD结构域作为辅助因子,研究人员成功地解析了OspC3ARD−caspase-4−Pro-IL-18三元复合物的晶体结构。复合物结构清晰地揭示Pro-IL-18以双位点的结合方式对称地结合在caspase-4二聚体界面的上下两端。其中切割位点LESD四肽序列深入caspase-4的酶活中心,形成第一个作用界面;而在caspase-4二聚体界面上,分子间β折叠作为caspase-4的外位点(exosite)与Pro-IL-18的propeptide和附近的结构元件,形成另一个作用界面。该exosite正是caspases识别焦亡底物蛋白GSDMD的关键位点。
三元复合物的结构也首次揭示了Pro-IL-18精细的结构特征。首先,Pro-IL-18的propeptide通过分子内相互作用与切割后的部分形成完整的球形结构,并直接参与了caspase-4 exosite介导的特异性识别。其次,Pro-IL-18切割后的部分与成熟形式的IL-18在结构上存在显著差异,需要发生剧烈的构象变化和局部的结构重排,产生新的结构元件,而这些新的结构元件对于成熟的IL-18与受体IL-18Rα结合至关重要。这表明caspases切割后的IL-18存在一个明确的结构成熟过程,也从机制上解释了pro-IL-18无法结合受体发挥生理功能的原因。
进一步通过序列和结构同源性分析,以及突变实验验证,研究人员证实非经典炎症小体通路的caspase-5和经典炎症小体通路的caspase-1也是通过保守的双位点结合方式特异地识别和活化Pro-IL-18。他们还发现小鼠的caspase-11不能有效地切割和活化鼠的Pro-IL-18。在炎症小体研究领域,人们往往使用小鼠作为实验对象与工具,这也是caspase-4−IL-18这条通路长期未被发现的原因之一。而通过序列和结构比较发现,caspase-11的exosite区域负责识别Pro-IL-18的关键氨基酸残基与caspase-4并不保守,破坏了其识别和切割Pro-IL-18的能力,将这些位点突变成caspase-4对应的残基,可以使caspase-11重新具有加工和活化Pro-IL-18的能力。
这项工作发现并证明炎症因子IL-18是非经典炎症小体通路活化的caspase-4/5的生理底物,并完整地揭示了天然免疫通路中caspases识别和切割Pro-IL-18,以及Pro-IL-18被加工后成熟为有生理功能的炎症因子的精确分子机制。成熟的IL-18重要的生理功能是诱导INFγ的产生,促进Th1型细胞免疫,非经典炎症小体通路识别和活化炎症因子IL-18的发现,也为天然免疫和适应性免疫的对话提供了全新的理解。在临床上,血液中高水平的IL-18与多种自身免疫疾病相关,如特异性皮炎、炎症性肠病和幼年特发性关节炎,这项工作为理解这些自身免疫疾病的发生机制以及开发新的干预策略提供了全新的思路。
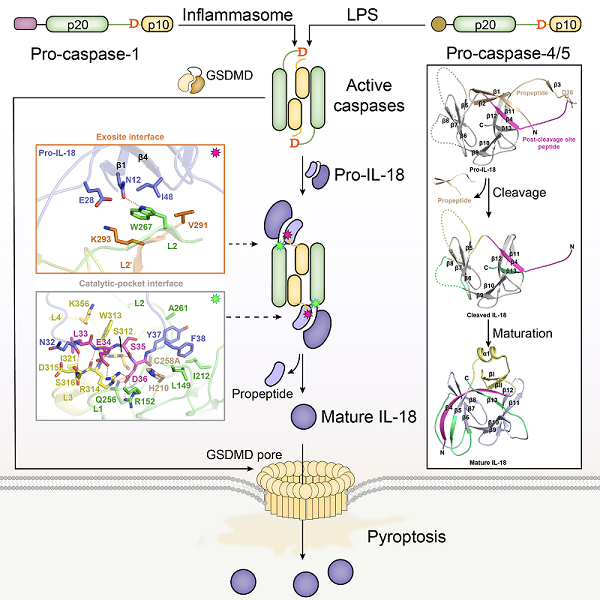
图:天然免疫炎症小体通路中caspases识别和活化炎症因子IL-18的示意图
北京生命科学研究所邵峰课题组的史旭焱博士与中国科学院生物物理研究所丁璟珒课题组的博士生孙启超为本文共同第一作者,邵峰研究员和丁璟珒研究员为本文的共同通讯作者,该研究得到中国科学院战略先导科技专项、国家自然科学基金委、科技部、中国医学科学院、中国科学院青促会和腾讯新基石等项目支持。
文章链接:
https://www.nature.com/articles/s41586-023-06742-w
(供稿:丁璟珒研究组)
 附件下载:
附件下载: