2023年11月8日,中国科学院生物物理研究所卜鹏程团队、郑州大学第一附属医院刘金波团队以及首都医科大学附属北京儿童医院张鹏团队合作,在《Developmental Cell》杂志发表了题为“CLMP is a tumor suppressor that determines all-trans retinoic acid response in colorectal cancer”的研究论文。该研究首次阐明了紧密连接蛋白家族的CLMP作为结直肠癌抑癌因子能够锚定β-catenin于细胞膜上进而抑制Wnt信号通路,并最终抑制了视黄酸分解酶CYP26A1的表达,增加了结直肠癌细胞对视黄酸的敏感性。
全反式视黄酸(ATRA),作为维生素A的主要活性物质,对急性早期幼粒细胞白血病有显著疗效。目前,已经开展了一系列临床试验验证ATRA在其他肿瘤中的治疗效果,如:黑色素瘤、神经胶质瘤、肺癌及胰腺癌等。结直肠癌是第二大癌症死亡原因,也是第三大最常见的癌症,然而,ATRA对结直肠癌的治疗效果仍缺乏临床实验数据,且ATRA在小鼠结直肠癌模型中的治疗效果一直存在争议。此外,CLMP作为紧密连接蛋白家族成员,其突变与先天性短肠综合征的发生密切相关,因此,CLMP在肠道发育过程中发挥重要作用。但是,CLMP在结直肠癌发生发展中的作用仍不清楚。
研究人员首先通过TCGA数据库及大量临床样本分析发现,与正常组织相比,CLMP在结直肠癌组织中显著下调,且其表达与结直肠癌病人预后正相关。随后,研究人员构建了肠上皮细胞特异性CLMP敲除小鼠,并通过AOM/DSS化学药物诱导的结直肠癌模型以及APCMin/+自发肠癌模型,进一步验证了CLMP在肠癌发生发展中的作用。结果显示,CLMP缺失能够明显促进肠癌的发生及生长。
接下来,通过免疫共沉淀及质谱实验,研究人员发现CLMP与β-catenin互作,能够将β-catenin锚定到细胞膜上、抑制其入核,进而抑制Wnt/β-catenin信号通路。进一步通过RNA-Seq分析发现,使ATRA分解失效的关键酶CYP26A1作为Wnt/β-catenin信号的靶基因,在CLMP敲除肿瘤中上调最为明显。而且,在CLMP高表达的CRC57结直肠癌细胞系中,CYP26A1低表达,对ATRA更为敏感;在CLMP低表达的SW620结直肠癌细胞系中,CYP26A1高表达,对ATRA不敏感。此外,在结直肠癌组织芯片的临床样本中,免疫组化实验结果显示,CLMP的表达与β-catenin的膜定位呈正相关,并与CYP26A1的表达呈负相关。在结直肠癌原位荷瘤小鼠模型、AOM/DSS小鼠模型以及APCMin/+小鼠模型中,CYP26A1抑制剂及ATRA联合治疗均能抑制肿瘤的发生及生长。
综上所述,该研究阐明了CLMP作为抑癌基因能够通过抑制β-catenin的核定位,抑制CYP26A1的表达,进而促进结直肠癌细胞对ATRA的敏感性(图1)。该研究首次揭示了新的抑癌因子CLMP抑制结直肠癌发生发展的分子机制,阐明了调控Wnt/β-catenin信号的新机制,并为临床上ATRA与CYP26A1抑制剂联合治疗结直肠癌提供了理论依据。
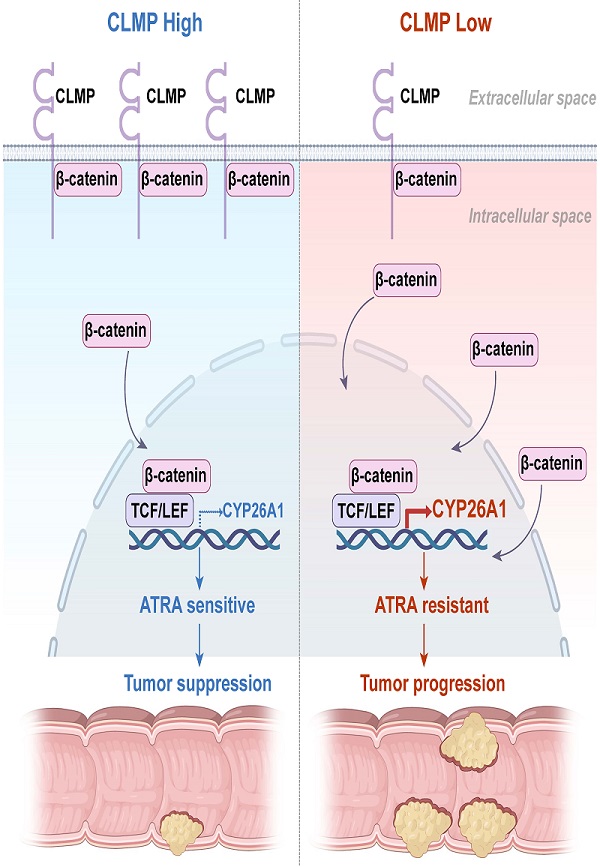
图1. CLMP调控结直肠癌细胞对ATRA敏感性示意图
中国科学院生物物理研究所卜鹏程研究员、郑州大学第一附属医院刘金波副教授以及首都医科大学附属北京儿童医院张鹏研究员为本文的共同通讯作者,中国科学院生物物理研究所助理研究员吴真真及博士研究生张萱萱为并列第一作者。该研究得到科技部、国家自然科学基金委、中国科学院及北京市自然科学基金委的经费支持。
文章链接:https://www.cell.com/developmental-cell/fulltext/S1534-5807(23)00525-7
(供稿:卜鹏程研究组)
 附件下载:
附件下载: